-
下列反应类型中一定属于氧化还原反应的是
A.置换反应 B.分解反应 C.化合反应 D.复分解反应
难度: 简单查看答案及解析
-
朱自清先生在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里…月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影…”月光穿过薄雾所形成的种种美景的本质原因是
A.青雾中的小水滴颗粒大小约为10﹣9m~10﹣7m
B.光是一种胶体
C.雾是一种胶体
D.发生丁达尔效应
难度: 简单查看答案及解析
-
下列实验操作中正确的是
A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B.蒸馏操作时,应使温度计水银球插入混合液体中
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
难度: 中等查看答案及解析
-
有人欲配制浓度较大的含有四种不同阴、阳离子的溶液,其中能配制成功的是
A.K+、H+、Cl-、CO32- B.Fe2+、Al3+、Cl-、SO42-
C.Na+、Cu2+、NO3-、OH- D.NH4+、Ba2+、CO32-、OH-
难度: 中等查看答案及解析
-
条件相同的理想气体,决定其所占体积大小的主要因素是
A.分子直径的大小 B.分子间距离的大小
C.组成分子的原子个数 D.分子数目的多少
难度: 简单查看答案及解析
-
下列有关说法正确的是
A.在同温同压下,相同体积的任何气体含有相同数目的原子
B.氧化还原反应的本质是有电子转移
C.Na2SO4溶液在电流作用下电离出Na+与SO42-而导电
D.NaCl固体不导电,所以NaCl不是电解质
难度: 中等查看答案及解析
-
在下列反应中水只起还原剂作用的是
A.2H2O
O2 ↑ + 2H2 ↑ B.Cl2 + H2O == HCl + HClO
C.2F2 + 2H2O == 4HF + O2 D.CaO + H2O == Ca(OH)2
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A.用醋酸除去水垢:CaCO3 + 2H+ ═ Ca2+ + H2O + CO2↑
B.铝片插入硝酸汞溶液中: Al + Hg2+ = Al3+ + Hg
C.Ba(OH)2与稀H2SO4反应:Ba2++2OH﹣+2H++SO42﹣═ BaSO4↓+2H2O
D.盐酸除铁锈:O2- + 2H+ ═ H2O
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的值,下列说法中正确的是
A.1L 1mol•L﹣1的CH3COOH溶液中含有NA个氢离子
B.物质的量浓度为0.5 mol•L﹣1的MgCl2溶液中,含有Cl﹣个数为NA
C.5.6 g铁与足量盐酸反应转移的电子数为0.3NA
D.1g O2和1g O3中所含有的电子数均为0.5NA
难度: 中等查看答案及解析
-
下列溶液中的Cl-浓度与50 mL 1 mol/L MgCl2溶液中的Cl-浓度相等的是
A.75 mL 1 mol/L NaClO3溶液 B.100 mL 1.5 mol/L CaCl2溶液
C.150 mL 2 mol/L KCl溶液 D. 75 mL 1 mol/L AlCl3溶液
难度: 中等查看答案及解析
-
对反应SO2 + I2 + 2H2O = H2SO4 + 2HI 中描述正确的是
A.反应中的氧化剂是SO2,还原剂是I2
B.反应中SO2被氧化,I2被还原
C.反应中有1mol电子转移,就有0.5mol SO2被还原
D.H2SO4既是氧化产物,又是还原产物
难度: 中等查看答案及解析
-
在标准状况下,1L的密闭容器中恰好可盛放n个H2分子和m个CO2分子组成的混合气体,则阿伏加德罗常数的数值可近似表示为
A.22.4(m+n)
B.22.4×6.02×1023(m+n)
C.22.4(m+n) / 6.02×1023
D.m+n
难度: 中等查看答案及解析
-
下列实验设计方案或判断正确的是
通过装有NaOH溶液的洗气瓶可除去二氧化碳中混有的HCl气体
B.向饱和的NaOH溶液中加入少量的Na2O固体后,恢复到原来的温度时,溶质的物质的量浓度增大
C.某无色溶液中加入BaCl2溶液,有白色沉淀生成,再滴入稀盐酸,沉淀不溶解,说明该溶液中一定含有SO42-
D.回收KMnO4加热分解产生的MnO2,可用溶解→过滤→洗涤→干燥
难度: 中等查看答案及解析
-
下图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在C、A处充入均为10g的X、Y两种气体,且测得二者的密度相等.当隔板停止滑动时,下列说法一定正确的是
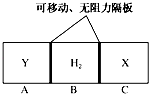
A.X、Y均为气体单质
B.X、Y的相对分子质量相等
C.n(H2)<n(X)= n(Y)
D.隔板停止滑动时,A、B、C三部分体积相等
难度: 中等查看答案及解析
-
已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:
Fe3+→Fe2+ MnO4-→ Mn2+ Cr2O72-→ Cr3+ HNO3→NO
如果分别用上述这些物质氧化KI得到等量的I2,消耗物质的量最少的物质是
A.Fe3+ B.MnO4- C.Cr2O72- D.HNO3
难度: 中等查看答案及解析
-
把7.4g Na2CO3·10H2O和NaHCO3组成的混合物完全溶解于水配成100mL溶液,其中c(Na+)=0.6mol/L。向溶液中加入足量的盐酸充分反应,将溶液蒸干后,所得固体质量是
A.2.12g B.3.51g C.4.22g D.5.28g
难度: 简单查看答案及解析