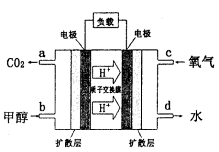
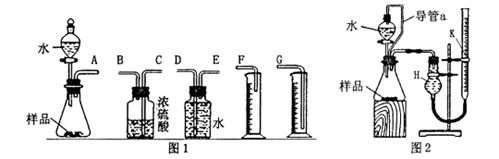
-
下列说法不正确的是
A.含铅汽油、含磷洗涤剂的使用均可对环境造成危害
B.棉花、木材及草类的纤维都是天然纤维
C.氮化硅陶瓷、光导纤维均属于新型无机非金属材料
D.煤、石油、天然气均属于可再生的化石燃料
难度: 中等查看答案及解析
-
下列有关化学用语使用正确的是
A.CO2的电子式:
B.中子数为20的氯原子:
C.正丁烷的结构简式:
D.铝离子结构示意图:
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.氯化铝溶液中加入过量氨水:
B.氨气通入醋酸溶液中:

C.氯化铁溶液中加入铁粉:
D.碳酸氢镁溶液中加入过量石灰水:

难度: 困难查看答案及解析
-
下列叙述中正确的是
A. C5H12的同分异构体有3种
B. 乙醇不能发生取代反应
C. 聚乙烯能使溴水褪色
D 甲醇、乙二醇(HOCH2CH2OH)互为同系物
难度: 中等查看答案及解析
-
下列实验操作能够实现的是
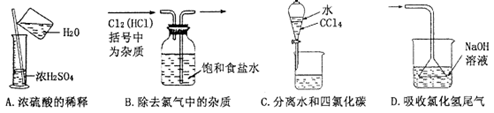
难度: 中等查看答案及解析
-
下列关于有机物的说法中,正确的一组是
①淀粉、油脂、蛋白质在一定条件下都能发生水解反应
②“乙醇汽油”是在汽油中加入适量乙醇而成的一种燃料,它是一种新型化合物
③除去乙酸乙酯中残留的乙酸,加过量饱和碳酸钠溶液振荡后,静置分液
④石油的分馏和煤的气化都是发生了化学变化
⑤淀粉遇碘酒变蓝色,在加热条件下葡萄糖能与新制Cu(OH)2悬浊液发生反应
⑥塑料、橡胶和纤维都是合成高分子材料
A.①③⑤ B.②④⑥ C.①②⑤ D.③④⑥
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A 1.8g的
离子中含有NA个电子
B. 标准状况下,22.4LSO3中含有NA个SO3分子
C. 常温常压下,33.6 LCl2中含有1.5NA个Cl2分子
D.
溶液中有2NA个Na +
难度: 困难查看答案及解析
-
下列关于有机物因果关系的叙述中,完全正确的一组是
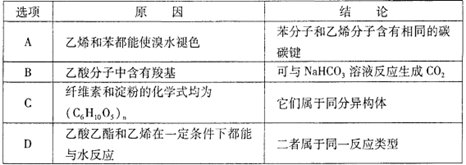
难度: 中等查看答案及解析
-
下列各组元素性质递变的关系错误的是
A.Li、Be、B原子最外层电子数逐渐增多
B.Li,Na,K的金属性依次增强
C.P、S、C1最高正价依次升高
D.N、0、F氢化物的稳定性依次减弱
难度: 中等查看答案及解析
-
某温度下纯水的
、在此温度下,将pH =8的Ba(OH)2溶液与 PH=5的稀盐酸混合。欲使混合溶液的pH =7,则氢氧化钡溶液与盐酸的体积比为
A.11:1 B.9: 2 C.1:11 D.2:9
难度: 中等查看答案及解析
-
某碱性蓄电池在充电和放电时发生的反应为:
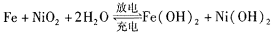 下列说法中正确的是
下列说法中正确的是A.放电时,负极上发生反应的物质是Fe
B.放电时,正极反应是
C.充电时,阴极反应是
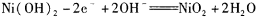
D.充电时,阳极附近PH增大
难度: 困难查看答案及解析
-
用水稀释
时,溶液中随着水量的增加而减小的是
A.
B.
C.c(H+)和c( OH-)的乘积
D.OH-的物质的量
难度: 中等查看答案及解析
-
对室温下PH相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关正确的是
A.加适量的醋酸钠晶体后,两溶液的pH均增大
B.温度升高20℃后,两溶液pH均不变
C.加水稀释2倍后,两溶液的pH同等程度减小
D.加足量的锌充分反应后,两溶液中产生的氢气一样多
难度: 中等查看答案及解析
-
对于反应
,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
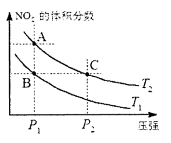
A. 两种不同的温度比较:T1>T2
B. A、C两点的反应速率:A〉C
C. B、C两点的气体的平均相对分子质量:B<C
D. 由状态B到状态A,可以用加热的方法实现
难度: 困难查看答案及解析
 。向一个容积不变的 容器中,充入2mol L和1molO2,使之充分反应,放出的热量为Q,则Q_______196. 6kJ (填“ >”、“〈”或“=”)。
。向一个容积不变的 容器中,充入2mol L和1molO2,使之充分反应,放出的热量为Q,则Q_______196. 6kJ (填“ >”、“〈”或“=”)。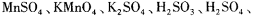
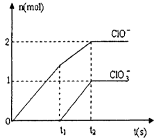
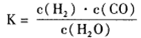
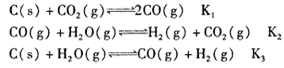
 , 该反应平衡常数随温度的变化如下:
, 该反应平衡常数随温度的变化如下:
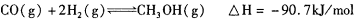
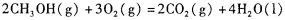 ,则负极的电极反应式为_______。
,则负极的电极反应式为_______。