-
据中央电视台报道,近年来我国的一些沿江城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾(分散质粒子直径在10-9~10-7m)属于哪种分散系( )
A.乳浊液 B.溶液 C.胶体 D.悬浊液
难度: 简单查看答案及解析
-
化学与科学、技术、社会、环境密切相关.下列有关说法中错误的是( )
A.2010年11月广州亚运会燃放的焰火是某些金属元素焰色反应所呈现出来的色彩
B.为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶
C.小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂
D.青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁
难度: 简单查看答案及解析
-
下列说法中错误的是
A.0.3 mol H2SO4 B.1 molH2O C.0.5 mol硫 D.3 mol氢原子
难度: 简单查看答案及解析
-
下列说法正确的是
A.纯碱、烧碱均属于碱
B.CuSO4·5H2O属于纯净物
C.凡能电离出H+的化合物均属于酸
D.盐类物质一定含有金属阳离子
难度: 简单查看答案及解析
-
下列叙述中正确的是( )
A.硫酸的摩尔质量是98g
B.铁原子的摩尔质量等于铁的相对原子质量
C.标准状况下,22.4L的O2质量是32g
D.2gH2所含原子物质的量为1mol
难度: 中等查看答案及解析
-
下列实验操作完全正确的是( )
编号
实 验
操 作
A
钠与水的反应
用镊子从煤油中取出金属钠,切下绿豆大小,放入装满水的烧杯中
B
配制一定浓度的氯化钾溶液500 mL
准确称取氯化钾固体,放入到500 mL的容量瓶中,加水溶解、振荡、摇匀、定容
C
闻氯气的方法
用手轻轻地在瓶口扇动,使极少量氯气飘进鼻孔
D
取出分液漏斗中所需的上层液体
下层液体从分液漏斗下端管口放出,关闭活塞,换一个烧杯,上层液体继续从分液漏斗下端管口放出
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.氨气通入醋酸溶液中:CH3COOH+NH3=CH3COONH4
B.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
C.氢氧化钡和稀硫酸:Ba2++OH﹣+H++SO42﹣=BaSO4↓+H2O
D.氧化镁中加稀盐酸:2H++MgO=H2O+Mg2+
难度: 中等查看答案及解析
-
某化学兴趣小组进行化学实验,按照左图连接好线路发现灯泡不亮,按照右图连接好线路发现灯泡亮,由此得出的结论不正确的是:
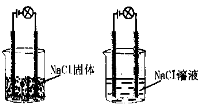
A.NaCl是电解质
B.NaCl溶液是电解质
C.NaCl在水溶液中电离出可以自由移动的离子
D.NaCl溶液可以导电
难度: 简单查看答案及解析
-
下列各组离子在指定溶液中能大量共存的是( )
A.无色溶液中:K+、Na+、MnO4﹣、SO42﹣
B.在酸性溶液中:Cu2+、Na+、SO42﹣、Cl﹣
C.加入Al能放出H2的溶液中:Cl﹣、HCO3﹣、SO42﹣、NH4+
D.含大量Fe2+溶液中:K+、Cl﹣、ClO﹣、Na+
难度: 简单查看答案及解析
-
下列分离或提纯物质的方法正确的是( )
A.用溶解、过滤的方法提纯含有少量BaSO4的BaCO3
B.用过滤的方法除去NaCl溶液中含有的少量淀粉胶体
C.用渗析的方法精制Fe(OH)3胶体
D.用加热→蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数,下列叙述正确的是( )
A. 11.2 L氧气中所含有的原子数为NA
B.标准状况下,22.4LCCl4所含分子数为NA
C.7.8g的Na2O2中含有的阴离子的数目为0.2NA
D.27gAl分别与足量的稀硫酸及氢氧化钠溶液反应失去的电子数都是3NA、
难度: 简单查看答案及解析
-
下列各组反应,最终一定能得到白色沉淀的是
A.向Al2(SO4)3溶液中加入过量NaOH溶液
B.向CuSO4溶液中加入NaOH溶液
C.向FeCl2溶液中加入过量NaOH溶液
D.向Na2SiO3溶液中加入稀盐酸
难度: 简单查看答案及解析
-
下列说法或做法正确的是( )
A.硅是地壳中含量位居第二的元素,玛瑙、光导纤维的主要成分为SiO2
B.可用Na与MgCl2溶液反应制Mg
C.常温下浓硫酸与铁不反应,故常温下可用铁制容器贮藏贮运浓硫酸
D.赏心悦目的雕花玻璃是用烧碱对玻璃进行刻蚀而制成的
难度: 中等查看答案及解析
-
下列各图示中能较长时间看到Fe(OH)2白色沉淀的是( )
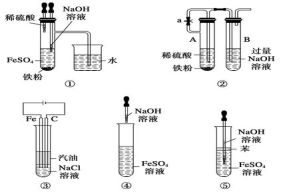
A.①②⑤ B.①②③ C.①② D.②③④
难度: 简单查看答案及解析
-
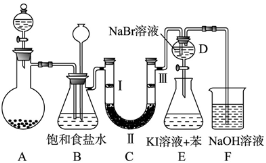
已知反应:①Cl2+2KBr=2KCl+Br2,②KClO3+6HCl=3Cl2+KCl+3H2O,③2KBrO3+Cl2=Br2+2KClO3,下列说法正确的是( )
A.上述三个反应都有单质生成,所以都是置换反应
B.氧化性由强到弱顺序为KBrO3>KClO3>Cl2>Br2
C.反应②中还原剂与氧化剂的物质的量之比为6:1
D.③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol
难度: 简单查看答案及解析
-
向混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列对溶液中溶质组成成分判断正确的是( )
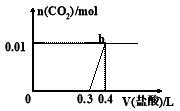
A.原溶液中溶质为Na2CO3和NaHCO3
B.原溶液中溶质为NaOH和Na2CO3
C.原溶液中溶质为Na2CO3
D.原溶液中溶质为NaHCO3
难度: 简单查看答案及解析