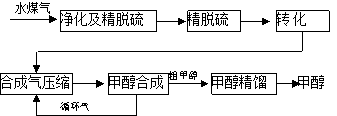
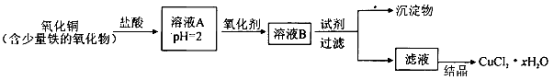
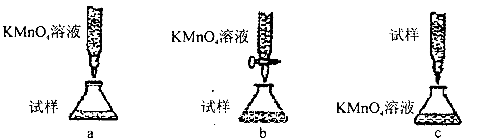
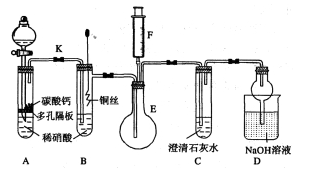
-
化学是你,化学是我,化学深入我们的生活。下列说法正确的是( )
A. 常温下,纯水的电离度为10-7×100%
B. 不能用溴水区分生物柴油和汽油
C. 海水淡化可使用冷冻法、离子交换法、电解法、反渗透法、明矾吸附法
D. 开发可燃冰,有利于节省化石燃料,并减少温室效应
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.将1mol明矾晶体完全溶于水制成胶体,其中所含胶体粒子数目为NA
B.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为5NA
C.0.1 mol·Lˉ1 CaCl2溶液中含有Clˉ离子的数目为0.2NA
D.136g熔融的KHSO4中含有2NA个阳离子
难度: 简单查看答案及解析
-
有X、Y两种元素,原子序数≤20,X的原子序数小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是( )
A. 若X的最高价含氧酸为强酸,则X的氢化物溶于水一定显酸性
B. 若Y的最高正价为+m,则X的最高正价一定为+m
C. 若X元素形成的单质是X2,则Y形成的单质一定是Y2
D. 若X(OH)n为强碱,则Y(OH)n也一定为强碱
难度: 困难查看答案及解析
-
烯烃在一定条件下发生氧化反应,碳碳双键断裂,如R1CH===CHR2被氧化为
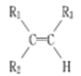 被氧化为
被氧化为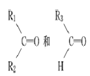 ,由此推断分子式为C4H8的烯烃的氧化产物有( )
,由此推断分子式为C4H8的烯烃的氧化产物有( )A.2种 B.3种 C.4种 D.6种
难度: 简单查看答案及解析
-
常温下,向20.00mL 0.1000mol·L-1(NH4)2SO4溶液中逐滴加入0.2000mol·L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。下列说法正确的是
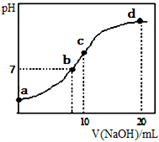
A. 点a所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+)
B. 点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-)
C. 点c所示溶液中:c(SO42-)+c(H+)=c(NH3•H2O)+c(OH-)
D. 点d所示溶液中:c(SO42-)>c(NH3•H2O)>c(NH4+)>c(OH-)
难度: 困难查看答案及解析
-
2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4–和有机阳离子构成电解质溶液,其放电工作原理如下图所示。下列说法不正确的是

A.放电时,铝为负极、石墨为正极
B.放电时,有机阳离子向铝电极方向移动
C.放电时的负极反应为:Al –3e- + 7AlCl4– = 4Al2Cl7–
D.充电时的阳极反应为:Cn + AlCl4––e- = CnAlCl4
难度: 中等查看答案及解析
-
下列设计的实验方案能达到相应实验目的是( )
选项
实验目的
实验方案
A
乙酸乙酯碱式水解完全
向水解后的溶液中滴加酚酞,变红
B
确定Ksp(BaCO3)>Ksp(BaSO4)
常温下,向BaCO3粉末加少量稀Na2SO4溶液,过滤,向洗净的沉淀中加稀盐酸,有气泡产生
C
证明反应速率会随反应物浓度的增大而加快
用3 mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL 1mol·Lˉ1Cu(NO3)2溶液,迅速产生较多气泡
D
通过观察液面差判断该装置的气密性
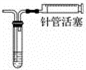 向右拉动注射器活塞并固定在某处,往试管中注水没过导气管口后,向左推活塞
向右拉动注射器活塞并固定在某处,往试管中注水没过导气管口后,向左推活塞A. A B. B C. C D. D
难度: 困难查看答案及解析