-
下列过程中,共价键被破坏的是( )
A.碘升华 B.溴蒸气被木炭吸附
C.酒精溶于水 D.HCl气体溶于水
难度: 简单查看答案及解析
-
下列化合物中,既有离子键,又有共价键的是 ( )
A.H2O B.CaCl2 C.KOH D.NH3
难度: 简单查看答案及解析
-
设C+CO2
2CO(正反应吸热),正反应的反应速率为v1;N2+3H2
2NH3(正反应放热),逆反应的反应速率为v2。对于上述反应,当温度升高时,v1 和v2的变化情况为( )
A.同时减小 B.同时增大
C.v1增大,v2减小 D.v1减小,v2增大
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.镍氢电池、锂离子电池和碱性锌锰干电池都是二次电池
B.燃料电池是一种高效但是会污染环境的新型电池
C.铅蓄电池放电时,正极材料是Pb,负极材料是PbO2
D.镍镉电池以Cd为负极,NiO(OH)为正极,KOH为电解质
难度: 简单查看答案及解析
-
下列说法中①物质发生化学反应都伴随着能量变化;②伴有能量变化的物质变化都是化学变化; ③酸和碱发生中和反应生成1mol水时所释放的热量称为中和热;④H20比H2S
的沸点高是因为H20中含有的化学键比 H2S强 ; ⑤Al与稀盐酸反应是放热反应; ⑥
Ba(OH)2.8H2O晶体与NH4Cl固体的反应是放热反应; ⑦CaCO3受热分解是吸热反应; ⑧
CaO与水的反应是放热反应; ⑨放热反应在常温下一定很容易发生,其中正确的组合( )
A.①②⑤⑥⑦⑩ B.①③⑤⑦⑧
C.①④⑤⑦⑧⑨ D.①③⑤⑥⑦⑧⑨
难度: 简单查看答案及解析
-
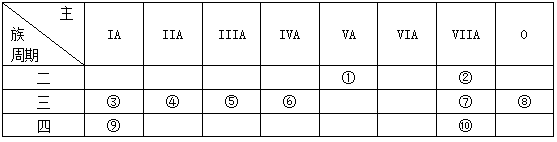
根据元素周期表判断,下列叙述不正确的是( )
A.若周期表中第七周期完全排满共有32 种元素
B.周期表共有18列,其中形成化合物种类最多的在第14 列
C.除过渡元素外周期表中最外层电子数相同的元素都位于同一族
D.L层电子数为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
难度: 简单查看答案及解析
-
化学键使得100多种元素构成了世界的万事万物。关于化学键的下列叙述中正确的是( )
A.离子化合物一定含有共价键,共价化合物中不含离子键
B.共价化合物可能含离子键,离子化合物中只含离子键
C.构成单质分子的粒子一定含有共价键
D.在Na2O中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子、原子核和原
子核之间的排斥作用
难度: 简单查看答案及解析
-
X、Y、Z均为元素周期表中前20号元素,mXa+、nYb-、Z(b+1)-简单离子的电子层结构相同,下列说法正确的是( )
A.已知mXa+与nYb-,得m+a=n-b B.离子半径:Yb->Z(b+1)-﹥Xa+
C.Z(b+1)-的还原性一定大于Yb- D.气态氢化物的稳定性Hb+1Z一定大于HbY
难度: 简单查看答案及解析
-
已知X元素的某种同位素的氯化物XCln 为离子化合物,在该化合物中X元素的微粒的核内中子数为m,核外电子数为y,则该同位素的符号是 ( )
难度: 简单查看答案及解析
-
下列各物质的性质比较中,正确的是( )
A.氢化物沸点:HI>HBr>HCl>HF B.原子半径:K>Cl>S
C.分子稳定性:HF>HCl>HBr>HI D.单质熔点:Li<Na<K<Rb
难度: 简单查看答案及解析
-
下列电子式书写正确的是 ( )
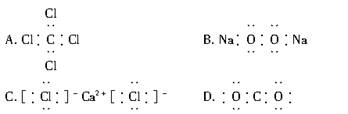
难度: 简单查看答案及解析
-
茫茫黑夜中,航标灯为航海员指明了方向。航标灯的电源必须长效、稳定。我国科技工作者研制出以铝合金,Pt、Fe合金网为电极材料的海水电池。有关这种电池的说法正确
的组合是 ( )
①铝合金是正极 ②铝合金是负极 ③海水是电解质溶液 ④铝合金电极发生还原反应
A.②③ B.②④ C.①② D.①④
难度: 简单查看答案及解析
-
下列叙述不正确的是( )
A.根据一次能源和二次能源的划分,氢气是二次能源
B.电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源
C.火电是将燃料中的化学能直接转化为电能的过程
D.在火电过程中,化学能转化为热能的过程实际上是氧化还原反应发生的过程,伴随着能量的变化
难度: 简单查看答案及解析
-
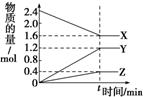
下列四个数据都表示合成氨的反应速率,N2+3H2
2NH3,其中代表同一反应速率的
是 ( )
①v(N2)=0.03 mol·L-1·min-1 ②v(NH3)=0.09 mol·L-1·min-1
③v(H2)=0.045 mol·L-1·min-1 ④v(H2)=0.135 mol·L-1·min-1
A.①② B.①③ C.③④ D.②④
难度: 简单查看答案及解析
-
可逆反应:2NO2(g)
2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦
C.①③④⑤ D.全部
难度: 简单查看答案及解析
-
如图所示,杠杆A、B两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁丝反应及两边浮力的变化) ( )
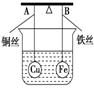
A.杠杆为导体和绝缘体时, 均为A端高B端低
B.杠杆为导体和绝缘体时, 均为A端低B端高
C.当杠杆为绝缘体时,A端低B端高;为导体时,A端高B端低
D.当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高
难度: 简单查看答案及解析
-
对于放热反应H2+Cl2=2HCl,下列说法中,正确的是( )
A.产物所具有的总能量高于反应物所具有的总能量
B.反应物所具有的总能量高于产物所具有的总能量
C.断开1 mol H-H键和1 mol Cl-Cl键所吸收的总能量大于形成2mol H-Cl键所放出的能量
D.该反应中,化学能只转变为热能
难度: 简单查看答案及解析
-
A、B、C、D、E是同周期从左向右按原子序数递增(短周期原子序数为五个连续的自然数)顺序排列的五种元素。则下列说法中正确的是( )
A.E元素的最高化合价为+7时,D元素的负化合价为–2价
B.A(OH)n为强碱时,B(OH)m也一定是强碱
C.HnDOm为强酸时,E的非金属性一定很强
D.HnCOm为强酸时,E的单质可能有强还原性
难度: 简单查看答案及解析
-
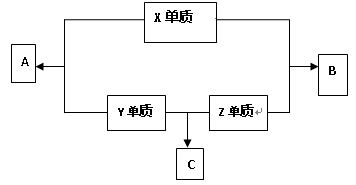
根据下列事实:①X+Y2+=X2++Y;②Z+2H2O(冷水)=Z(OH)2+H2↑;③Z2+的氧化性比X2+弱;④由Y、W电极组成的原电池,电极反应为W2++2e-=W、Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为( )
A.X﹥Z﹥Y﹥W B.Z﹥W﹥X﹥Y
C.Z﹥Y﹥X﹥W D.Z﹥X﹥Y﹥W
难度: 简单查看答案及解析
-
近来,科学家研制了一种新型的乙醇电池,它用磺酸类质子作溶剂,在2000C左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全。电池总反应式为:C2H5OH+3O2→
2CO2+3H2O。下列说法不正确的是( )
A.C2H5OH在电池的负极上参加反应
B.1mol乙醇被氧化转移6mol电子
C.在外电路中电子由负极沿导线流向正极
D.电解质溶液中阳离子移向正极,阴离子移向负极
难度: 简单查看答案及解析
-
一种11H、21H是氢元素的两种核素,168O、188O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法中正确的是( )
A.168O、188O的核外电子排布不相同
B.通过化学反应,可以实现168O和188O之间的相互转化
C.18g 11H2168O中所含电子数为10NA
D.18g 21H2168O中含中子数为10NA
难度: 简单查看答案及解析
-
下列装置能够组成原电池的是( )
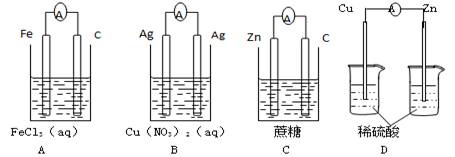
难度: 简单查看答案及解析