-
下列有关化学反应速率的说法正确的是( )
A. 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B. 100mL 2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C. SO2的催化氧化是一个放热的反应,所以,升高温度,反应的速率减慢
D. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
难度: 中等查看答案及解析
-
500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A. 原混合溶液中c(K+)为1 mol·L-1
B. 上述电解过程中共转移4 mol电子
C. 电解得到的Cu的物质的量为0.5 mol
D. 电解后溶液中c(H+)为2 mol·L-1
难度: 困难查看答案及解析
-
下列变化不能用勒夏特列原理解释的是( )
A. 红棕色的NO2气体加压后颜色先变深再变浅
B. 实验室中常用饱和食盐水除去Cl2中混有的HCl
C. 二氧化硫转化为三氧化硫时增加空气的量以提高二氧化硫的转化率
D. H2、I2、HI混合气体加压后颜色变深
难度: 中等查看答案及解析
-
已知;(NH4)2CO3(s)═NH4HCO3(s)+NH3(g)△H=+74.9kJ·mol﹣1,下列说法中正确的是( )
A. 该反应中熵变、焓变皆大于0
B. 该反应是吸热反应,因此一定不能自发进行
C. 碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行
D. 能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应
难度: 中等查看答案及解析
-
下列叙述不正确的是( )
A. 原电池是将化学能转化为电能的装置
B. 铁船底镶嵌锌块,锌作负极,以防船体被腐蚀
C. 钢铁腐蚀的负极反应:Fe﹣3e﹣═Fe3+
D. 把锌片放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
难度: 中等查看答案及解析
-
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断 裂时吸收热量496 kJ,氢气中1 mol H―H键断裂时吸收热量为436 kJ,求水蒸气中1 mol H―O键形成时放出热量( )
A. 463kJ B. 557 kJ C. 486kJ D. 188 kJ
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 对于有气体参与的反应,增大压强,活化分子数增多,化学反应速率增大
B. 对放热反应而言,升高温度,活化分子百分数减少,反应速率减小
C. 活化分子间发生的碰撞为有效碰撞
D. 使用催化剂,活化分子百分数增多,化学反应速率增大
难度: 中等查看答案及解析
-
已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
A. 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣2b kJ·mol﹣1
B. C2H2(g)+
O2(g)═2CO2(g)+H2O(l)△H=+2b kJ·mol﹣1
C. 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣4b kJ·mol﹣1
D. 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+b kJ·mol﹣1
难度: 中等查看答案及解析
-
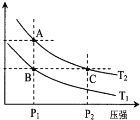
a1、a2分别为A在甲、乙两个恒温容器中建立平衡体系A(g)
2B(g)时的转化率,已知甲容器保持压强不变,乙容器保持容器体积不变。在温度不变的情况下,均增加A的物质的量,下列判断正确的是( )
A. a1、a2均减小 B. a1减小,a2增大
C. a1、不变,a2增大 D. a1不变,a2减小
难度: 困难查看答案及解析
-
在500℃时,把0.3mol SO2和0.2mol O2充入一个体积为10L并盛有V2O5(催化剂)的真空密闭容器中,保持温度不变,经2min后,容器内的压强不再变化,此时容器内压强减小20%。下列说法正确的是( )
A. 该温度下此反应的平衡常数K=400
B. 其他条件不变,再充入0.3mol SO2和0.2mol O2平衡时,SO2的体积分数增大
C. 平衡时,SO2的转化率为95%
D. 前2min SO2的平均反应速率0.02mol/(L·s)
难度: 困难查看答案及解析
-
可逆反应:2NO(g)+O2(g)
2NO2(g),在体积不变的密闭容器中反应,一定达到平衡状态的标志是( )
A.单位时间内生成n mol O2的同时生成n mol NO2
B.混合气体的颜色不再改变的状态
C.ν(NO2):ν(NO):ν(O2)=2:2:1的状态
D.混合气体的密度不再改变的状态
难度: 中等查看答案及解析
-
我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其他电池,电池总反应为V2O5 + xLi
LixV2O5。下列说法合理的是( )
A. 电池在放电时,Li+向负极移动
B. 锂在放电时作正极,充电时作阳极
C. 该电池充电时阳极的反应为LixV2O5 - xe- =V2O5 + xLi+
D. V2O5只是锂发生反应的载体,不参与电池反应
难度: 困难查看答案及解析
-
对下列实验的描述不正确的是( )
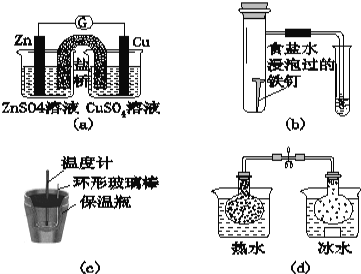
A.图(a)所示的实验:根据检流计(G)中指针偏转的方向比较Zn、Cu的金属活泼性
B.图(b)所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀
C.图(c)所示的实验:根据温度计读数的变化用稀盐酸和稀NaOH溶液反应测定中和热
D.图(d)所示的实验:根据两烧瓶中气体颜色的变化判断2NO2(g)
N2O4(g)是放热反应
难度: 困难查看答案及解析
-
对于可逆反应:2A(g)+B(g)
2C(g) △H<0,下列各图中正确的是( )
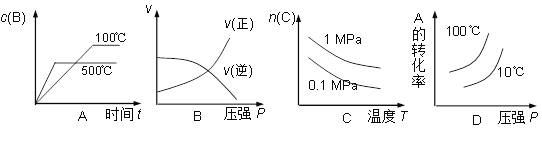
难度: 困难查看答案及解析
-
在密闭容中发生下列反应aA(g)
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变小 B. 平衡向正反应方向移动
C. D的体积分数变大 D. a> c+d
难度: 中等查看答案及解析
-
关于下列各装置图的叙述中,不正确的是( )
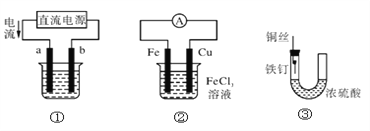
A. 用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B. 用装置①进行电镀,镀件接在b极上
C. 装置②的总反应是:Cu+2Fe3+===Cu2++2Fe2+
D. 装置③中的铁钉几乎没被腐蚀
难度: 中等查看答案及解析
-
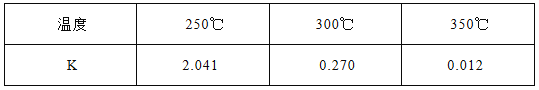
固定容积为2L的密闭容器中发生反应xA(g)+yB(g)
zC(g),图I表示t℃时容器中各物质的量随时间的变化关系,图II表示平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是
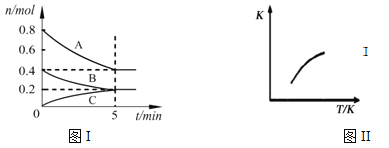
A. 该反应可表示为:2A(g)+B(g)
C(g)ΔH﹤0
B. t℃时该反应的平衡常数K=6.25
C. 当容器中气体密度不再变化时,该反应达到平衡状态
D. t℃,在第6 min时再向体系中充入0.4 mol C,再次达到平衡时C的体积分数大于0.25
难度: 中等查看答案及解析