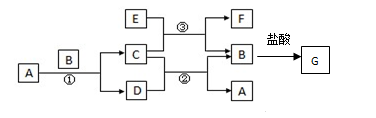
-
下列有关化学常识正确的是
A.钠钾合金可用于中子反应堆作热交换剂
B.氯气本身有毒,因此不能用于药物合成
C.不用氧化镁电解熔融制镁的原因是氧化镁不导电
D.工业高炉炼铁过程中,加石灰石主要是为了制备还原剂
难度: 简单查看答案及解析
-
菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有五价砷,西红柿中含有比较多的维生素C,两者同食时会生成有毒的三价砷。下列说法正确的是
A.“两者同食”发生的反应中维生素C作氧化剂
B.五价砷在维生素C作用下发生了还原反应
C.因为河虾中含有砷元素,所以不能食用
D.可以推测砒霜中所含的砷元素化合价为+5
难度: 困难查看答案及解析
-
设阿伏加德罗常数的数值为NA,下列叙述正确的是
A.0.5 mol·L-1 NaOH溶液中Na+数为0.5NA
B.标准状况下,22.4 L四氯化碳含有的分子数为NA
C.常温常压下,1mol Na2O2与足量CO2反应, 电子转移数为NA
D.标准状况下,16 g氧气臭氧的混合气体所含原子数一定为2NA
难度: 简单查看答案及解析
-
1个SO32-离子恰好将1个XO4-离子还原,则X元素在还原产物中化合价是
A.+2 B.+3 C.+4 D.+5
难度: 中等查看答案及解析
-
在下列各氧化还原反应中,水既不作氧化剂,也不作还原剂的是
A.2F2+2H2O=4HF+O2 B.2Al+2H2O+2NaOH=2NaAlO2+3H2↑
C.2K+2H2O=2KOH+H2↑ D.2Na2O2+2H2O=4NaOH+O2↑
难度: 中等查看答案及解析
-
某元素原子的质量数为A,它的阴离子Xn-核外有x个电子,w克这种元素的原子核内中子数为
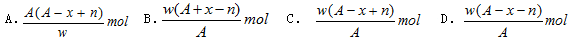
难度: 中等查看答案及解析
-
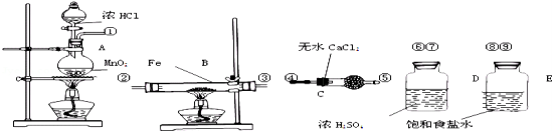
下列实验装置图所示的实验操作,正确的是
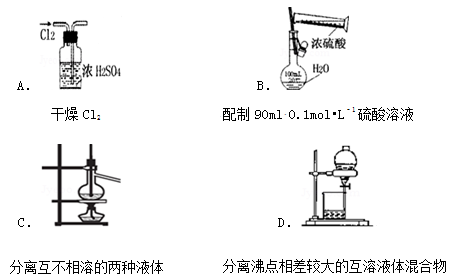
难度: 中等查看答案及解析
-
下列化学用语正确的是
A.硫酸铁的化学式为FeSO4
B.氧离子结构示意图:
C.碳酸氢钠的电离方程式 NaHCO3=Na++HCO3-
D.质量数为37的氯核素符号:
难度: 中等查看答案及解析
-
下列物质既能与酸反应又能与碱反应的是
A.MgO B.AlCl3 C.KAlO2 D.NaHCO3
难度: 中等查看答案及解析
-
2.3g由CO与H2组成的混合气体与足量的O2充分燃烧后,产物气体立即通入足量的Na2O2固体中,固体的质量增加( )
A.2.3g B.3.2g C.4.6g D.不可求
难度: 中等查看答案及解析
-
下面有关Na2CO3与NaHCO3的性质说法错误的是
A.热稳定性:NaHCO3<Na2CO3
B.不可用氢氧化钙鉴别两者
C.两溶液碱性相同时的浓度:Na2CO3>NaHCO3
D.与同浓度的硫酸溶液反应放出气泡的快慢程度:NaHCO3>Na2CO3
难度: 中等查看答案及解析
-
一定温度下,向饱和NaOH溶液中投入一小块金属钠,充分反应后恢复到原来温度。下列叙述中,合理的是
A.NaOH溶液浓度增大,并放出H2
B.溶液中NaOH的质量分数不变,有H2放出
C.总溶液的质量增大,有H2放出
D.总溶液的质量不变,有H2放出
难度: 中等查看答案及解析
-
向下列溶液中通过量的CO2,一定产生浑浊的是
A、澄清石灰水 B、BaCl2溶液 C、NaAlO2溶液 D、Na2CO3溶液
难度: 中等查看答案及解析
-
下列反应的离子方程式错误的是
A、向碳酸氢钙溶液中加过量氢氧化钠Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
B、等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合
Ba2++OH-+HCO3-=BaCO3↓+H2O
C、氯化铝与过量氨水反应 Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D、过量CO2通入氢氧化钡的稀溶液中 CO2+OH-=HCO3-
难度: 简单查看答案及解析
-
某透明溶液中加铝放出氢气,则在该溶液中一定能大量共存的离子组是
A.K+、Br-、Cl-、SO42- B.SCN-、Fe3+、Cl-、K+
C.K+、Cu2+、SO42-、Na+ D.Na+、ClO-、NO3-、SO42-
难度: 中等查看答案及解析
-
只用溴水就可以将下列物质鉴别出来的是
A.水、CCl4、酒精、苯
B.NaCl溶液、NaBr溶液、NaI溶液、NaOH溶液
C.AgNO3溶液、NaOH溶液、KI溶液、CCl4
D.CCl4、酒精、NaCl溶液、KI-淀粉溶液
难度: 中等查看答案及解析
-
下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象相同的是
A.Ba(HCO3)2溶液,Ba(OH)2溶液
B.稀硝酸,Na2CO3溶液
C.稀H2SO4溶液,NaAlO2溶液
D.NaOH溶液,AlCl3溶液
难度: 中等查看答案及解析
-
下列说法不正确的是
A.定容时,因不慎使液面高于容量的刻度线,需重新配制
B.焰色反应时,先用稀盐酸洗涤铂丝并在酒精灯火焰上灼烧至无色,然后进行实验
C.将新制氯水滴入紫色石蕊溶液中,可以看到石蕊溶液先变红后褪色
D.取少量晶体放入试管中,加入适量稀NaOH溶液,在试管口用湿润的红色石蕊试纸检验,若试纸变蓝,则可证明该晶体中含有NH4+
难度: 中等查看答案及解析
-
向明矾KAl(SO4)2.12H2O溶液里滴入Ba(OH)2溶液, 当SO42-恰好完全沉淀时,其中元素的存在形式为
A.全部形成AlO2-
B.全都为Al(OH)3
C.一部分为Al(OH)3,一部分为Al3+
D.一部分为Al(OH)3,一部分为AlO2-
难度: 中等查看答案及解析
-
今已知反应:①Cl2+2KBr=2KCl+Br2,②KClO3 +6HCl=3Cl2+KCl +3H2O,
③2KBrO3 +Cl2=Br2 + 2KClO3,下列说法正确的是
A.上述三个反应都有单质生成,所以都是置换反应
B.反应②中还原剂与氧化剂的物质的量之比为6∶1
C.氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2
D.③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol
难度: 中等查看答案及解析
-
如图所示是向MgCl2和AlCl3的混合溶液中加入一定量NaOH溶液,紧接着再加入一定量稀盐酸,生成沉淀的物质的量y与加入溶液的体积x的关系图。根据图示判断,下列结论中不正确的是
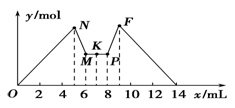
A.N点时溶液中的溶质只有NaCl
B.c(NaOH)=c(HCl)
C.原混合溶液中c(MgCl2)∶c(AlCl3)=1∶2
D.K点之前加入的是NaOH溶液,K点之后加入的是盐酸
难度: 中等查看答案及解析
-
用1L的1.0mol·L-1NaOH 溶液吸收0.7molCO2,所得溶液中的CO32-和HCO3-的浓度之比约是
A.1∶2 B.1∶3 C.2∶3 D.3∶4
难度: 中等查看答案及解析
-
甲、乙两烧瓶中各盛有100mL 3mol·L-1的盐酸和氢氧化钾溶液,向两烧瓶中分别加入等质量的铝粉,反应结束测得甲、乙生成的气体体积比为2∶3(相同状况),则加入铝粉的质量为
A.1.60g B.2.70g C. 4.05g D.5.60g
难度: 中等查看答案及解析
-
已知Br2+2Fe2+=2Br -+2Fe3+ , 现向含溶质a mol的FeBr2溶液中通入b mol Cl2,充分反应。下列说法不正确的是
A.离子的还原性强弱:Fe2+>Br->Cl-
B.当氯气少量时,发生的离子反应:2Fe2++Cl2=2Fe3++2Cl-
C.当a=b时,反应后溶液的离子浓度:c(Fe3+)︰c(Br-)︰c(Cl-)=1︰2︰2
D.当氯气过量时,发生离子反应:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
难度: 中等查看答案及解析
-
欲测定某氢氧化钠样品中可能的变质成分碳酸钠的含量,张同学取该样品少量放于烧杯中,向其中慢慢滴加10%的稀盐酸,所加盐酸与产生气体的质量关系图如下:
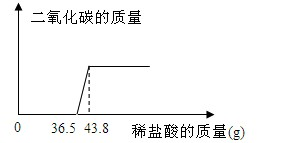
(1)求反应完毕后产生二氧化碳的质量?
(2)原固体中氢氧化钠的质量分数是多少?(结果保留一位小数)
难度: 中等查看答案及解析