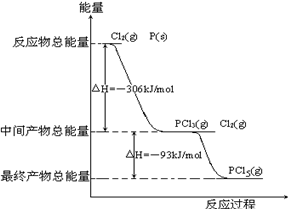
-
下列说法正确的
A.放热反应在常温下一定容易进行
B.植物的光合作用是把太阳能转化为热能的过程
C.反应是放热还是吸热是由反应物和生成物所具有的能量的相对大小决定的
D.凡是在加热或点燃条件下进行的反应都是吸热反应
难度: 简单查看答案及解析
-
已知石墨在高温、高压及催化剂存在的条件下能转化为金刚石,该反应为吸热反应,由此可知
A.石墨比金刚石稳定 B.石墨总能量比等质量的金刚石高
C.该变化属于物理变化 D.该反应的焓变△H<0
难度: 简单查看答案及解析
-
已知:H+(aq) + OH-(aq) = H2O(l) △H =-57.3 kJ·mol-1。
对于下列反应:
①HCl(aq) + NH3·H2O(aq) = NH4Cl(aq) + H2O(l) △H =-a kJ·mol-1
②HNO3(aq) + KOH(aq) = KNO3(aq) + H2O(l) △H =-b kJ·mol-1[
则a、b的大小关系为
A.a>b B.b>a C.a = b D.无法比较
难度: 简单查看答案及解析
-
将氯化铝溶液蒸干灼烧并熔融后用铂电极进行电解,下列有关电极产物的判断正确的是
A.阴极产物是氢气 B.阳极产物是氧气
C.阴极产物是铝和氧气 D.阳极产物是氯气
难度: 简单查看答案及解析
-
某学生欲完成2HCl + 2Ag = 2AgCl + H2↑的反应,设计了如图所示的四个实验,你认为可行的实验是
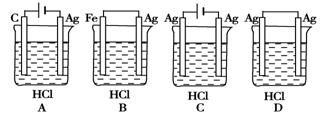
难度: 简单查看答案及解析
-
将含有0.4 mol CuSO4和0.2 mol KCl的水溶液1 L,用惰性电极电解一段时间后,在一个电极上析出19.2 g Cu,此时在另一电极上放出的气体在标准状况下的体积为(忽略气体在水中的溶解)
A.3.36 L B.4.48 L C.5.60 L D.6.72 L
难度: 简单查看答案及解析
-
把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若A、B相连时,A为负极;C、D相连,D上有气泡逸出;A、C相连时,A极减轻;B、D相连,B为正极。则四种金属的活泼性顺序由大到小排列为
A.A>C>D>B B.A>C>B>D
C.A>B>C>D D.B>D>C>A
难度: 简单查看答案及解析
-
已知反应Cu(s) + 2Ag+(aq) = Cu2+(aq) + 2Ag(s)为一自发进行的氧化还原反应,将其设计成如图所示原电池。下列说法中正确的是
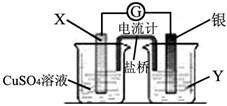
A.电极X是正极,其电极反应为Cu-2e- = Cu2+
B.银电极质量逐渐减小,Y溶液中c(Ag+)增大
C.实验过程中取出盐桥,原电池仍继续工作
D.当X电极质量减少0.64 g时,外电路中有0.02 mol电子转移
难度: 简单查看答案及解析
-
右图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是
A.生铁块中的碳是原电池的正极
B.两试管中相同的电极反应式是:Fe-2e-= Fe2+
C.红墨水柱两边的液面变为左低右高
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
难度: 简单查看答案及解析
-
某化学兴趣小组用铝片与稀硫酸反应制取氢气,以下能够加快该反应速率的是
①用98%的浓硫酸代替稀硫酸 ②加热 ③改用铝粉 ④增大稀硫酸的体积 ⑤加水 ⑥加入少量硫酸铜
A.全部 B.②③⑥ C.①②③⑥ D.②③④⑥
难度: 简单查看答案及解析
-
对于固定体积的密闭容器中进行的气体反应A(g) + B(g)
C(g) + D(g),可以说明在恒温下该反应已达到平衡的是
A.反应容器的压强不随时间而变化 B.A气体和B气体的生成速率相等
C.A气体和C气体的生成速率相等 D.反应混合气体的密度不随时间而变化
难度: 简单查看答案及解析
-
工业上制备纯硅反应的化学方程式为SiCl4(g) + 2H2(g)
Si(s) + 4HCl(g) △H>0,下列措施能提高反应速率且使平衡向正反应方向移动的是
A.升温 B.加压 C.减压 D.加催化剂
难度: 简单查看答案及解析
-
I2在KI溶液中存在下列平衡:I2(aq) + I-(aq)
I3-(aq)。某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
A.反应 I2(aq) + I- (aq)
I3-(aq)的△H>0
B.状态A与状态B相比,状态A的c(I2)大
C.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1<K2
D.若反应进行到状态D时,一定有v正>v逆
难度: 简单查看答案及解析
-
一定温度下可逆反应A(s) + 2B(g)
2C(g) + D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动)。下列说法正确的是

A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B.保持温度和乙中的压强不变,分别向甲、乙中加入等质量的氦气后,甲中平衡不移动,乙中平衡向正反应方向移动
C.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均减少
D.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
难度: 简单查看答案及解析
-
下列事实一定能说明HF是弱酸的是
①常温下NaF溶液的pH大于7
②用HF溶液做导电性实验,灯泡很暗
③HF与NaCl不能发生反应
④常温下0.1 mol·L-1的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体
⑥HF与水能以任意比混溶
A.①④ B.②③⑤ C.③④⑥ D.①②④
难度: 简单查看答案及解析
-
物质的量浓度相同的下列溶液,pH由大到小排列正确的是
A.Ba(OH)2、Na2SO3、FeCl3、KCl
B.Na2SiO3、Na2CO3、KNO3、NH4Cl
C.NH3·H2O、Na2SO4、H2SO4、H3PO4
D.NaHCO3、Na2CO3、C2H5OH、HCl
难度: 简单查看答案及解析
-
对于0.1 mol·L-1 Na2SO3溶液,正确的是
A.升高温度,溶液pH降低
B.c(Na+) = 2c(SO32-) + c(HSO3-) + c(H2SO3)
C.c(Na+) + c(H+) = 2c(SO32-) + 2c(HSO3-) + c(OH-)
D.加入少量NaOH固体,c(SO32-)与c(Na+)均增加
难度: 简单查看答案及解析
-
室温下,取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则该原溶液的浓度为
A.0.01 mol·L-1 B.0.017 mol·L-1 C.0.50 mol·L-1 D.0.05 mol·L-1
难度: 简单查看答案及解析
-
已知0.1 mol·L-1的二元酸H2A溶液的pH=4,则下列说法中正确的是
A.在Na2A和NaHA溶液中,离子种类不相同
B.在NaHA溶液中一定有:c(Na+) + c(H+) = c(HA-) + c(OH-) + 2 c(A2-)
C.在Na2A溶液中一定有:c(OH-) = c(H+) + c(HA-) + c(H2A)
D.在溶质物质的量浓度相等的Na2A和NaHA溶液中,阴离子总数相等
难度: 简单查看答案及解析
-
在25 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是

A.对于曲线上AB间任一点,溶液中都有:c(Na+) >c(CH3COO-) >c(OH-) >c(H+)
B.在B点,a>12.5,且有c(Na+) = c(CH3COO-) = c(OH-) = c(H+)
C.在C点,c(CH3COO-) - c(Na+) = c(H+) - c(OH-)
D.在D点,c(CH3COO-) + c(CH3COOH) = c(Na+)
难度: 简单查看答案及解析