-
小龙同学在工具书中查到NaOH在水和酒精中的溶解度(见下表)。通过分析她得出以下结论,其中不正确的是( )
20 ℃
40 ℃
水
109 g
129 g
酒精
17.3 g
40 g
A. 温度和溶剂种类对NaOH的溶解度都有影响
B. NaOH易溶于水,也易溶于酒精
C. 40 ℃,40 g NaOH溶解在100 g酒精中达到饱和
D. 将等质量40 ℃的饱和NaOH水溶液和饱和NaOH酒精溶液降温至20 ℃,析出的晶体前者比后者多
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 硝酸铵固体溶于水是吸热过程
B. 乙醇与水混合可形成溶液
C. 饱和溶液的质量分数一定大于不饱和溶液
D. 氯化钠溶液能够导电是因为溶液中存在自由移动的离子
难度: 中等查看答案及解析
-
生活中的下列现象不能说明气体溶解度随温度升高而减小的是( )
A. 烧开水时,沸腾前有气泡逸出 B. 阳光充足时,盛满水的鱼缸壁上有小气泡
C. 启开啤酒瓶盖,有大量泡沫溢出 D. 夏季黄昏时,池塘里的鱼浮出水面
难度: 中等查看答案及解析
-
把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是( )
A. 面粉 B. 氯化钠 C. 泥土 D. 乳胶漆
难度: 中等查看答案及解析
-
要将一瓶接近饱和的石灰水变成饱和溶液,小明选择了如下方法,其中可行的是( )
①加入CaO ②加入Ca(OH)2 ③升高温度 ④降低温度
A. ②③ B. ②④ C. ①②③ D. ①②④
难度: 中等查看答案及解析
-
下列固体物质溶于水的过程中,溶液温度显著升高的是( )
A. 氢氧化钠 B. 氯化钠 C. 硝酸铵 D. 蔗糖
难度: 简单查看答案及解析
-
下列有关溶液的说法正确的是( )
A. 溶液都是无色、透明的 B. 溶液由溶质和溶剂组成
C. 均一、稳定的液体都是溶液 D. 溶质都以分子形式溶解在溶剂里
难度: 中等查看答案及解析
-
下列有关洗涤问题的说法中,不正确的是( )
A. 汽油可溶解衣服上的油渍 B. 洗洁精可乳化餐具上的油污
C. 盐酸能洗去暖水瓶内壁的水垢 D. 酒精能洗涤瓷砖上的铁锈
难度: 简单查看答案及解析
-
用浓盐酸配制一定溶质质量分数的稀盐酸,实验时必不可少的一组仪器是( )
A. 玻璃棒 量筒 烧杯 胶头滴管 B. 托盘天平 量筒 烧杯 玻璃棒
C. 托盘天平 玻璃棒 烧杯 胶头滴管 D. 量筒 烧杯 漏斗 玻璃棒
难度: 中等查看答案及解析
-
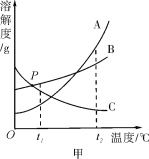
甲、乙两种固体物质(均不含结晶水)的溶解度曲线如图所示,下列说法错误的是( )
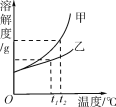
A. t2 ℃时,将甲、乙的两种饱和溶液分别降温到t1℃,所得溶液都是饱和溶液
B. t1 ℃时,向50 g水中加入甲可得80 g饱和溶液,则乙在该温度下的溶解度为60 g
C. 甲中混有少量乙时,可用降温结晶的方法提纯甲
D. t2 ℃时,将等质量的甲、乙两种溶液分别降温到0 ℃,甲溶液的溶质质量分数一定小于乙溶液的溶质质量分数
难度: 中等查看答案及解析
-
潍坊有丰富的海洋资源,氯化钠占整个海洋盐类的80%以上。下列有关氯化钠的说法正确的是( )
A. 室温下的氯化钠饱和溶液不能再溶解氯化钾
B. 取出部分上层溶液,可将接近饱和的氯化钠溶液变为饱和
C. 可用水鉴别氯化钠和氢氧化钠
D. 将100 g质量分数为20%的氯化钠溶液稀释为10%,所用的仪器只有烧杯、量筒、玻璃棒
难度: 简单查看答案及解析
-
有100 g 10%的盐酸溶液,要使其溶质质量分数增大一倍,应采取的方法是(提示:盐酸易挥发)( )
A. 把溶液的量倒掉一半 B. 与200 g 25%的盐酸混合
C. 溶质的质量增大一倍 D. 蒸发掉溶剂的质量是原溶液质量的一半
难度: 简单查看答案及解析
-
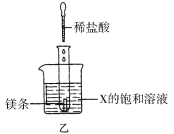
下列实验能用下图表示的是( )
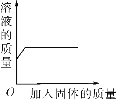
A. 向硝酸铜溶液中加入铁粉
B. 向过氧化氢溶液中加入二氧化锰
C. 向一杯接近饱和的石灰水中加入氧化钙
D. 向不饱和的硝酸钾溶液中加入硝酸钾
难度: 简单查看答案及解析
-
电解氢氧化钠稀溶液与电解水的原理均可表示为:2H2O
2H2↑+O2↑。电解一定质量氢氧化钠稀溶液的过程中,下列说法正确的是( )
A. 溶液氢氧化钠的质量分数减小 B. 溶液中氢元素质量分数减少
C. 溶液中钠元素质量变大 D. 溶液中氢、氧元素质量比不变
难度: 简单查看答案及解析