-
我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指( )
A. 萃取 B. 渗析 C. 蒸馏 D. 过滤
难度: 中等查看答案及解析
-
下列关于 60Co的叙述中,错误的是( )
A. 质子数是27,电子数是27 B. 质量数是60,中子数是27
C. 钴元素属于第四周期的过渡元素 D. 钴的同位素中质子数相同而中子数不同
难度: 简单查看答案及解析
-
下列有关说法正确的是( )
A. 一氯甲烷的电子式为
B. 乙醇分子的球棍模型为

C. 苯的结构简式为C6H6 D. 分子组成为C5H12的有机物有3种
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 化合反应都是放热反应
B. 在化学反应中形成新化学键时要吸收能量
C. 可以通过改变温度控制化学反应的限度
D. 决定化学反应速率的因素是反应物的浓度
难度: 简单查看答案及解析
-
如图所示装置中,明显有电流产生的是( )
A.
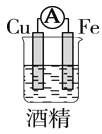 B.
B. 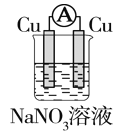
C.
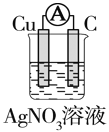 D.
D. 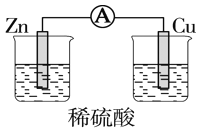
难度: 中等查看答案及解析
-
构成氯化钠的两种微粒的结构示意图是下列的
①
②
③
④
⑤
⑥
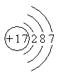
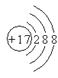
A. ①⑥ B. ②⑤ C. ③④ D. ③⑤
难度: 简单查看答案及解析
-
下列物质属于共价化合物的是( )
A. H2SO4 B. Cl2 C. Na2O2 D. MgCl2
难度: 简单查看答案及解析
-
下列叙述错误的是( )
A. 乙烯使溴水褪色是因为发生了加成反应
B. 二氧化硫使溴水褪色是因为发生了氧化还原反应
C. 用乙酸和乙醇反应制备乙酸乙酯发生了酯化反应
D. 乙酸乙酯在酸性条件下的水解反应程度更大
难度: 简单查看答案及解析
-
下列有机物中,完全燃烧时生成的二氧化碳和水的物质的量之比为1∶1的是( )
A. 乙烷 B. 乙烯 C. 乙炔 D. 乙醇
难度: 中等查看答案及解析
-
下列各组中的两种物质互为同分异构体的是( )
A. 正丁烷和异丁烷 B. 甲烷和乙烷 C. 金刚石和石墨 D.
O2和
O2
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次递增,X原子的最外层电子数是内层电子数的3倍,X、W同主族。Y、Z是同周期相邻的两种元素,Y的最高价氧化物对应的水化物是一种两性化合物。下列判断正确的是( )
A. 原子半径:r(W)>r(Z)>r(Y)>r(X)
B. Y元素的最高价氧化物对应的水化物既能与盐酸反应,也能与氨水反应
C. 最简单气态氢化物的热稳定性:W>Z
D. W元素的单质在暗处能与H2剧烈化合并发生爆炸
难度: 中等查看答案及解析
-
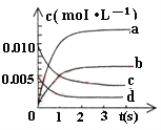
一定温度下,向一恒容密闭容器中充入2 mol SO2和1 mol O2,在一定条件下发生反应: 2SO2+O2
2SO3,下列有关说法正确的是( )
A. 当O2的浓度不变时,反应达到平衡状态
B. 达到化学平衡时,正反应和逆反应的速率相等且都为零
C. 当单位时间消耗a mol O2,同时消耗2a mol SO2时,反应达到平衡状态
D. 当SO2、O2、SO3的分子数比为2∶1∶2时,反应达到平衡状态
难度: 中等查看答案及解析
-
化学能可与热能、电能等相互转化。下列表述不正确的是( )
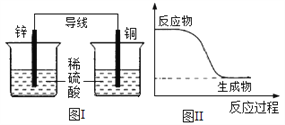
A. 有能量变化是化学反应的基本特征之一
B. 图I所示的装置能将化学能转变为电能
C. 图II所示的反应为放热反应
D. 化学反应中能量变化的主要原因是化学键的断裂与形成
难度: 中等查看答案及解析
-
下列推测或结论不合理的是( )
A. X2-和Y+核外电子层结构相同,原子序数:X<Y
B. 气态氢化物的稳定性HCl>HBr,非金属性:Cl > Br
C. 硅、锗都位于金属与非金属的交界处,都可以作半导体材料
D. Li和Be是同周期的元素,碱性:LiOH﹤Be(OH)2
难度: 中等查看答案及解析
-
下列过程中发生了取代反应的是( )
A. 苯加入溴水中,振荡并静置后下层液体变为无色
B. 在催化剂作用下乙烯生成聚乙烯
C. 在铜催化、加热条件下,乙醇与氧气反应
D. 乙醇和乙酸在浓硫酸作用下加热生成乙酸乙酯
难度: 中等查看答案及解析
-
下列有关化学反应速率的说法中正确的是 ( )
A. 100 mL 2 mol·L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
B. 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
C. 汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
D. 二氧化硫的催化氧化是一个放热反应,所以升高温度,反应速率减慢
难度: 中等查看答案及解析
-
等质量的铜片在酒精灯上加热后,分别插入下列溶液中,放置片刻,铜片质量不变的是
A. 硝酸 B. 无水乙醇 C. 石灰水 D. 盐酸
难度: 中等查看答案及解析
-
下列实验不能达到预期目的的是( )
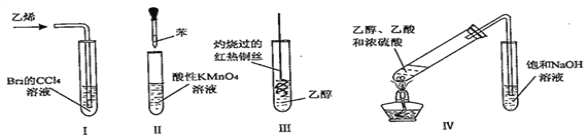
A. I探究乙烯与Br2的加成反应
B. II探究苯分子是否含有碳碳双键
C. III探究乙醇的还原性
D. IV制取少量乙酸乙酯
难度: 中等查看答案及解析
-
下列实验操作不能达到相应实验目的的是( )
选项
实验目的
实验操作
A
比较水与乙醇中氢的活泼性
分别将少量钠投入到乙醇和水中,观察现象
B
检验淀粉的水解反应是否进行完全
向水解液中加入碘水,观察溶液是否变蓝
C
提纯含有少量乙烯杂质的甲烷
将混合气体通入盛有水的洗气瓶
D
验证催化剂对化学反应速率的影响
在两支试管中各加入5mL 12%H2O2溶液,将其中一支中加入MnO2,观察并比较实验现象
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
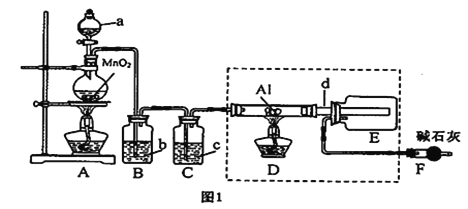
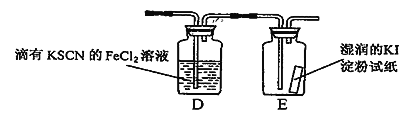
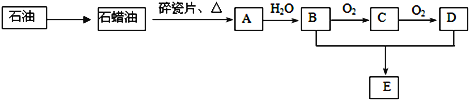
铝-海水-空气电池在航海中得到广泛的应用,其以海水做为电解液,电池的电极反应式分别为:Al-3eˉ=Al3+,O2 + 2H2O + 4eˉ=4OHˉ,下列说法正确的是( )
A. 该电池的正极是铝,发生氧化反应
B. 电池工作时,电子通过外电路从负极流向正极,再从电解质溶液流回负极。
C. 该电池的正极反应物是氧气
D. 该电池实现了将电能转化为化学能
难度: 中等查看答案及解析