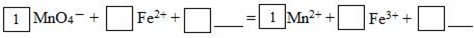-
下列有关生活或工业中的化学叙述,正确的是( )
A.加碘食盐能使淀粉溶液变蓝
B.向高硫煤中加入生石灰,可减少燃煤对大气的污染
C.绿色化学的核心是应用化学反应原理对环境污染进行治理
D.PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成混合物属于胶体
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A.Na的结构示意图
B.多电子原子中,在离核较远区域运动的电子能量较低
C.非金属元素组成的化合物中可能有共价键和离子键
D.HF、HCl、HBr、HI的热稳定性和还原性依次增强
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.在反应5NH4NO3
2HNO3+4N2↑+9H2O中,每生成4 mol N2,转移电子数为10NA
B.12.5 mL 16 mol·L-1浓硫酸与足量铜反应,转移电子数为0.2NA
C.标准状况下,1.12L的SO3所含的原子数约为0.2NA
D.标准状况下,2.2gCO2气体中所含分子数为0.05NA
难度: 中等查看答案及解析
-
下列试剂的贮存方法不正确的是( )
A.钠保存在煤油中
B.盛放NaOH溶液时,使用带玻璃塞的试剂瓶
C.在存放液溴的试剂瓶中应加水封
D.保存氯化亚铁溶液时,要加入少量的铁粉
难度: 中等查看答案及解析
-
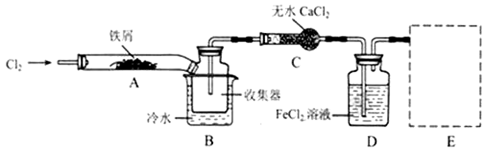
据图装置和表中提供的物质完成实验室制取、收集表中气体并进行尾气处理 (省略夹持、加热及净化装置),最合理的选项是( )

选项 a中的物质 b中的物质 c中收集的气体 d中的物质
A 浓氨水 CaO NH3 H2O
B 稀硫酸 石灰石 CO2 NaOH溶液
C 稀硝酸 Cu NO2 H2O
D 浓盐酸 MnO2 Cl2 NaOH溶液
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.NaHCO3溶液显碱性:HCO3-+H2O
H3O++CO32-
B.在明矾溶液中滴加过量氨水:Al3++4NH3·H2O=[Al(OH)4]-+4NH4+
C.显蓝色的淀粉溶液中通入SO2后变成无色溶液:I2 +SO2+2H2O=2I-+SO42-+4H+
D.小苏打溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
难度: 中等查看答案及解析
-
在相同条件下的三个反应: 2A- +B2 =2B- +A2; 2C- +A2 =2A- +C2; 2B- +D2 =2D- +B2,下列判断不正确的是( )
A.氧化性: B2 > A2 B.还原性: C- > D-
C.2A- +D2 =2D- + A2 反应可以进行 D.2C- +B2 =2B- + C2反应不能进行
难度: 中等查看答案及解析
-
下列物质中,既能与盐酸反应又能与NaOH溶液反应的是( )
①NaHCO3 ② Al(OH)3 ③ Al2O3 ④ (NH4)2SO3 ⑤Al
A.①② B.②③⑤ C.①②④⑤ D.全部
难度: 中等查看答案及解析
-
有一未完成的离子方程式为:____+XO32-+6H+=3X+3H2O,据此判断,X元素的最高化合价为( )
A.+4 B.+6 C.+5 D.+7
难度: 中等查看答案及解析
-
下列实验中金属或金属氧化物可以完全溶解的是( )
A.常温下将64g铜片投入过量浓硫酸中
B.向100.0mL 3.00mol/L的稀硝酸中加入5.6g铁
C.1 mol MnO2粉末与含4molHCl的浓盐酸共热
D.常温下1 mol铝片投入20.0mL 18.40mol/L硫酸中
难度: 中等查看答案及解析
-
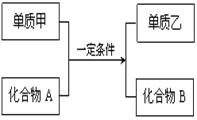
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:
。下列有关物质的推断不正确的是( )
A.若甲为焦炭,则丁可能是O2 B.若甲为SO2,则丁可能是氨水
C.若甲为Fe,则丁可能是氯气 D.若甲为NaOH 溶液,则丁可能是AlCl3
难度: 中等查看答案及解析
-
为除去混入CO2中的SO2和O2,下列试剂的使用顺序正确的是: ( )
①饱和Na2CO3溶液;②饱和NaHCO3溶液;③浓H2SO4溶液;④灼热的铜网;⑤碱石灰
A.①③④ B.②③④ C.②④③ D.③④⑤
难度: 中等查看答案及解析
-
下列变化能用同一性质解释的有( )
①浓硫酸和浓盐酸在空气中敞口放置时浓度均减小;②二氧化硫和氯气均能使品红溶液褪色;③二氧化硫能使品红溶液、溴水褪色;④氨气和碘化氢气体均不能用浓硫酸干燥;⑤常温下浓硫酸用铁制的容器存放、加热条件下浓硫酸能与木炭反应⑥浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字;⑦二氧化碳、二氧化硫使澄清石灰水变浑浊
A.1个 B.2个 C.3个 D.5个
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列说法正确的是( )
A.原子半径的大小顺序: r(Y)>r(Z)>r(W)
B.元素Z、W 的简单离子的电子层结构不同
C.元素Y 的简单气态氢化物的热稳定性比Z 的强
D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物
难度: 困难查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是:( )
选项 实验操作 实验现象 结论
A 洁净的铁钉在浓硝酸中浸泡片刻,蒸馏水冲洗后,再放入CuSO4溶液 铁钉表面无红色物质生成 铁钉在浓硝酸中已钝化
B 向溶液X中先滴加稀NaOH溶液,再将湿润红色石蕊试纸置于试管口附近 试纸不变蓝 原溶液X中肯定无NH4+
C 向PbO2中滴入浓盐酸 有黄绿色气体 PbO2具有还原性
D 向溶液X 中先滴加氯水,再滴加KSCN溶液 溶液变红 溶液X中一定含有Fe2+
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中X所处的周期序数与族序数相等。下列说法错误的是( )
A.Z的氧化物与W的氧化物的化学键类型相同
B.X、Z的氧化物都能溶于氢氧化钠和稀硫酸溶液中
C.最高价氧化物对应水化物稀溶液的氧化性:W<Z
D.Y原子的半径比W原子的半径大
难度: 中等查看答案及解析
-
下列物质的分类结果全部正确的是( )
A.CO2——酸性氧化物 Na2O2——碱性氧化物 Al2O3——两性氧化物
B.漂白粉——混合物 胆矾——纯净物 HD——化合物
C.纯碱——碱 硫化氢——酸 小苏打——酸式盐
D.SO2——非电解质 硫酸钡——强电解质 醋酸——弱电解质
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中可能大量共存的是( )
A.在碱性溶液中:K+、Cl-、Na+、 CO32-
B.在c(H+)/ c(OH-)=1×10-12的溶液中:Ca2+、Cl-、K+、NH4+
C.澄清透明溶液中:Cu2+、Fe3+、I-、SO42-
D.与铝粉反应放出氢气的无色溶液中:K+、NO3-、Cl-、HCO3-
难度: 中等查看答案及解析
-
常温下,下列不发生反应的一组物质是( )
①铜与浓硫酸 ②二氧化硅与NaOH溶液 ③铜与浓硝酸 ④石英与纯碱
⑤铁与液氯 ⑥一氧化氮与氧气 ⑦硅与氧气 ⑧H2S与SO2
A. ①②③⑥ B. ②③⑥⑧ C. ①④⑤⑦ D. ①②③⑦
难度: 中等查看答案及解析
-
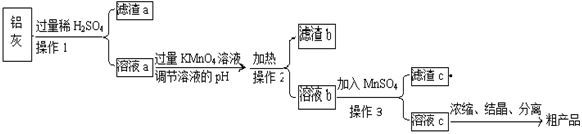
水溶液X中只可能溶有K+、Mg2+、Al3+、[Al(OH)4]-、
、
、
、
中的若干种离子。某同学对该溶液进行了如下实验:
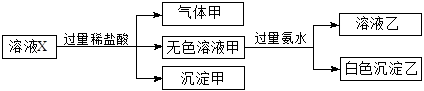
下列判断正确的是( )
A.气体甲一定是纯净物
B.K+、[Al(OH)4]-和
一定存在于溶液X中
C.沉淀甲是硅酸和硅酸镁的混合物
D.
和
一定不存在于溶液X中
难度: 困难查看答案及解析
-
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示),下列有关说法不正确的是( )

A.从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将电能转化为化学能的过程
B.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2
C.在过程③⑤中溴元素均被氧化
D.除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:
Na2CO3溶液→NaOH溶液→ BaCl2溶液→过滤后加盐酸
难度: 中等查看答案及解析
-
中学化学教材中,常借助于图像的这一表现手段清晰地突出实验装置的要点、形象地阐述化学过程的原理。下列有关化学图像表现的内容正确的是( )
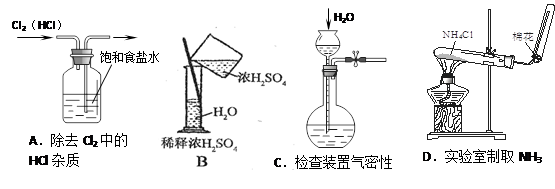
难度: 中等查看答案及解析
-
取一定质量的均匀固体混合物Cu、Cu2O和 CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为 ( )
A.3.2mol/L B.2.8mol/L C.1.8mol/L D.缺数据无法计算
难度: 中等查看答案及解析