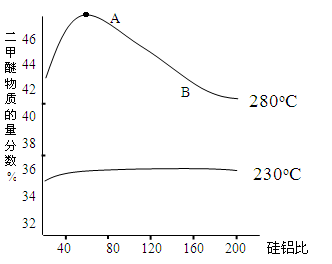
-
下列说法正确的是
A.在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀
B.司母戊鼎、定远舰甲板、有机玻璃等原材料属于合金
C.聚酯纤维、碳纤维、光导纤维都属于有机高分子材料
D.石蜡油受热分解产生了可以使酸性高锰酸钾溶液褪色的烯烃
难度: 简单查看答案及解析
-
在水溶液中能大量共存的一组离子是
A.Na+、Fe3+、I-、OH-
B.Fe2+、Na+、Cl-、SO42-
C.K+、Fe3+、NO3-、SCN-
D.H+、Fe3+、CO32-、SO42-
难度: 简单查看答案及解析
-
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是

难度: 中等查看答案及解析
-
设nA为阿伏加德罗常数的数值,下列说法正确的是
A.常温常压下,16 g O2含有nA个氧原子
B.1mol苯含有3nA个碳碳单键和3nA个碳碳双键
C.一定条件下,3molH2和1molN2充分反应后,可得到2nA个NH3分子数
D.1 mol·L-1 FeCl3溶液中含有Cl-总数为3nA
难度: 中等查看答案及解析
-
某小组为研究电化学原理,设计了下图所示的电化学装置,电极I为锌,其他电极均为石墨,盐桥是浸泡了饱和氯化钾溶液的琼脂,丙池是滴加了酚酞的氯化钠溶液。下列叙述正确的是
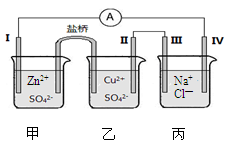
A.电子由电极IV通过外电路流向电极I
B.装置工作过程中III电极周围出现红色
C.电极II发生还原反应
D.盐桥中Cl—向乙池移动
难度: 中等查看答案及解析
-
常温下,0.1 mol·L-1CH3COONa溶液pH=11,下列表述正确的是
A.c(Na+) = c(CH3COO—)
B.c(CH3COO—) + c(CH3COOH)=0.1 mol·L-1
C.由水电离出来的c(OH—)= 1.0×10-11 mol·L-1
D.往该溶液中加入0.05 mol·L-1的CH3COONa,pH值变大
难度: 中等查看答案及解析
-
X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如下图所示。已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1。下列说法正确的是

A.Y、Z、W处于同一周期
B.Y、W的最简单氢化物的水溶液能相互反应
C.非金属性:Y<Z
D.X、Z、W形成的化合物均为强酸
难度: 中等查看答案及解析
-
下列实验操作、现象和结论均正确的是

难度: 中等查看答案及解析