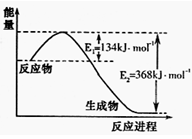
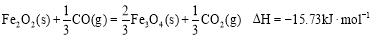-
下列说法正确的是
A.需要加热才能发生的反应一定是吸热反应
B.放热反应在常温下一定很容易发生
C.放热反应还是吸热反应主要由反应物、生成物所具有的总能量的相对大小决定
D.吸热反应发生过程中要不断从外界获得能量,放热反应不需要外界能量
难度: 简单查看答案及解析
-
下列各项与反应热的大小无关的是
A.反应物和生成物的状态
B.反应物(量)的多少
C.反应物的性质
D.反应热的单位
难度: 简单查看答案及解析
-
298 K时,反应 N2 (g) + 3H2 (g)
2NH3 (g) △H =-92.0 kJ/mol。将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
A.一定大于92.0 kJ B.一定等于92.0 kJ
C.一定小于92.0 kJ D.不能确定
难度: 简单查看答案及解析
-
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,向1L1mol·L-1的下列溶液中分别加入1L1mol·L-1的NaOH溶液:①稀醋酸;②稀硫酸;③稀盐酸,完全反应的热效应△H1、△H2、△H3的关系正确的是
A.△H1>△H2>△H3 B.△H1<△H3<△H2
C.△H1=△H3>△H2 D.△H2=△H3<△H1
难度: 简单查看答案及解析
-
在相同的温度和压强下,将32g硫分别于纯氧中和空气中完全燃烧,前者放出的热量为△H1,后者放出的热量为△H2,则关于△H1和△H2的相对大小,正确的判断是
A.△H1=△H2 B.△H1>△H2 C.△H1<△H2 D.无法判断
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数,下列叙述正确的是 ( )
A.高温下60gSiO2与足量纯碱反应,最多中释放出2NA个气体分子
B.1molC5H12分子中共价键总数为14NA
C.78g Na2O2固体与足量的H2O反应转移的电子数为NA
D.标准状况下,2.24LNH3和CH4的混合气体,所含电子总数为2NA
难度: 中等查看答案及解析
-
下列条件下,两瓶气体所含原子数一定相等的是
A.不同质量、不同密度的N2和CO
B.同温度、同体积的H2和N2
C.同体积、同密度的C2H4和C3H6
D.同压强、同体积的N2O和CO2
难度: 简单查看答案及解析
-
某非金属单质A和氧气发生化合反应生成B。B为气体,其体积是反应掉氧气体积的两倍(同温同压)。以下对B分子组成的推测一定正确的
A.有1个氧原子 B.有2个氧原子 C.有1个A原子 D.有2个A原子
难度: 中等查看答案及解析
-
某研究性学习小组欲用化学方法测量一个不规则容器的体积。把35.1 g NaCl放入 500 mL烧杯中,加入150 mL蒸馏水。待NaCl完全溶解后,将溶液全部转移到容器中,用蒸馏水稀释至完全充满容器。从中取出溶液100 mL,该溶液恰好与 20 mL 0.100 mol·L-1 AgNO3溶液完全反应。则该容器的体积为
A.30 L B.20 L C.10 L D.40 L
难度: 中等查看答案及解析
-
已知溶质质量分数为96%的酒精溶液的物质的量浓度为 16.6 ·mol·L-1,则8.3 mol·L-1的酒精溶液的溶质的质量分数为
A.大于48% B.等于48% C.小于48% D.无法确定
难度: 简单查看答案及解析
-
甲醇在催化剂作用下提供质了(H+)和电子,电子经外电路,质子经内电路到达另一极与氧气反应,电池总反应式为2CH3OH+3O2→2CO2+4H2O。下列关于该电池的分析:
①甲醇是负极
②H+向负极移动
③负极反应:CH3OH-6e—+H2O=CO2+6H+
④1 mol CH3OH完全反应转移12mol电子
⑤正极反应:O2+4e—+2H2O=4OH—
⑥该电池的电解质溶液可能是碱液。其中正确的是 ( )
A.①②⑥ B.②③④⑤ C.③ D.①③
难度: 简单查看答案及解析
-
将2 molX和2molY充入2L密闭容器中发生如下反应:X(气)+3Y(气)
2Z(气)+aQ(气)2min达到平衡时生成0.8molZ,测得Q的浓度为0.4mol/L,下列叙述错误的是( )
A.a的值为2
B.平衡时X的浓度为0.8mol/L
C.Y的转化率为60%
D.反应速率v(Y)=0.6mol/(L·min)
难度: 中等查看答案及解析
-
在体积恒定的密闭容器中,充入3 mol A和1 mol B发生反应:3A(g)+B(g)
xC(g),达到平衡后,C在平衡混合气体中的体积分数为φ。若维持温度不变,按1.2 mol A、0.4 mol B、0.6 mol C为起始物质,达到平衡后压强不变,C的体积分数仍为φ,则x值是( )
A.2 B.1 C.3 D.4
难度: 简单查看答案及解析
-
两种浓度不同的NaOH溶液,c(H+)分别为1.0×10―14 mol·L―1和1.0×10―12mol·L―1,将这两种溶液等体积混合后,所得溶液的c(H+)约为
A. 0.5×(10―14+10―12) mol·L―1
B. 5×(10―15+10―11) mol·L-1
C. 2.0×10―1 mol·L―1
D. 2.0×10―14 mol·L―1
难度: 简单查看答案及解析
-
硫化氢水溶液(氢硫酸)中有如下动态平衡:H2S
H++HS―;HS―
H++S2―;H2O
H++OH―。在0.1 mol·L―1的H2S溶液中,下列关系正确的是
A. 2c(H+)=2c(HS―)+c(S2―)+2c(OH―)
B.c(H+)=c(HS―)+2c(S2―)+c(OH―)
C. c(H+)=c(HS―)+2c(S2―)
D. c(H+)=2c(S2―)+c(OH―)
难度: 简单查看答案及解析
-
某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH值升高,则该电解质可能是
A.NaOH B.H2SO4 C.AgNO3 D.Na2SO4
难度: 简单查看答案及解析
-
已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“—”。关于标有“+”的接线柱,下列说法中正确的是
A.充电时作阳极,放电时作负极
B.充电时作阳极,放电时作正极
C.充电时作阴极,放电时作负极
D.充电时作阴极,放电时作正极
难度: 简单查看答案及解析
-
某混合溶液中只含有两种溶质NaCl和H2SO4,且n(NaCl)︰n(H2SO4)=3︰1。若以石墨电极电解该溶液,下列推断中不正确的是
A.阴极产物为H2
B.阳极先析出Cl2,后析出O2
C.电解液的pH不断增大,最终大于7
D.整个电解的过程实质是电解水
难度: 中等查看答案及解析
-
根据下列实验事实:(1) X+Y2+ = X2+ + Y (2) Z + 2H2O
Z(OH)2 + H2↑ (3)Z
离子的氧化性比X
弱 (4)由Y、W作电极组成的原电池反应为:Y—2e-=Y2+,由此可知,X、Y、Z、W的还原性由强到弱的顺序是
A.X > Y > Z > W
B.Y > X > W > Z
C.Z > X > Y > W
D.Z > Y > X > W
难度: 简单查看答案及解析
-
下图
为直流电源,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为电镀槽.接通电路后发现
上的c点显红色.为实现铁上镀锌,接通
后,使c、d两点短路.下列叙述正确的是
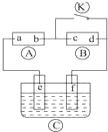
A.a为直流电源的负极
B.c极发生的反应为2H++2e-=H2↑
C.f电极为锌板
D.e极发生还原反应
难度: 简单查看答案及解析
-
下列说法正确的是
A.活化分子间所发生的碰撞为有效碰撞
B.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大的主要原因是增加了单位体积内活化分子的百分数
D.有气体参与的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子总数,从而使反
应速率增大
难度: 中等查看答案及解析
-
已知某可逆反应:mA(g) + nB(g)
pC(g),在密闭容器中进行,下图表示在不同时间t、温度T、压强p与反应物B的百分含量的关系曲线,下列判断正确的是
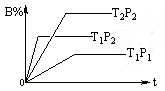
A.T2>T1 P1>P2 m+n>P △H <0
B.T1>T2 P1<P2 m+n<P △H >0
C.T1<T2 P1<P2 m+n<P △H <0
D.T1>T2 P1<P2 m+n>P △H >0
难度: 简单查看答案及解析
-
下列操作中能使电离平衡H2O
H++OH―,向右移动且溶液呈酸性的是
A.将水加热到100℃,使pH=6
B.向水中加入Al2(SO4)3固体
C.向水中加入Na2CO3溶液
D.向水中加入NaHSO4溶液
难度: 简单查看答案及解析
-
250℃和1.01×105 Pa时,该反应能自发进行:2N2O5(g) = 4NO2(g) + O2(g) △H= +56.76 kJ/mol,其自发进行的原因是
A.是吸热反应
B.是放热反应
C.是熵减少的反应
D.熵增大效应大于能量效应
难度: 简单查看答案及解析