-
用NA表示阿伏伽德罗常数,下列说法正确的是( )
A.0.2 mol H2O2完全分解转移的电子数为0.4NA
B.含NA个Na+的Na2O溶于1L水中,Na+的物质的量浓度为1mol•L-1
C.在标准状况下,2.8g N2和2.24LCO所含电子数均为1.4NA
D.2.24L SO2与O2混合气体中所含氧原子数为0.2NA难度: 中等查看答案及解析
-
下列由相关实验现象所推出的结论正确的是( )
A.Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
B.向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO2-4
C.Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应
D.分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水难度: 中等查看答案及解析
-
化学与科学、技术、社会、环境密切相关,下列有关说法中不正确的是( )
A.煤经过气化和液化两个物理变化,可变为清洁能源
B.服用铬含量超标的药用胶囊会对人体健康造成危害
C.“地沟油”危害健康,处理方式之一,可以通过水解将“地沟油”制成肥皂
D.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”难度: 中等查看答案及解析
-
下列化学用语中书写错误的是( )
A.硫离子的结构示意图:
B.次氯酸的结构式:
C.CO2的比例模型:
D.原子核内有10个中子的氧原子:O
难度: 中等查看答案及解析
-
在含FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的Na2O2固体,在空气中充分搅拌反应后再加入过量的稀盐酸,溶液中阳离子数目变化最小的是( )
A.Na+
B.Al3+
C.Fe3+
D.Fe2+难度: 中等查看答案及解析
-
某反应由两步反应A⇌B⇌C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示能量).下列有关叙述正确的是( )
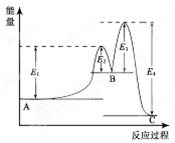
A.两步反应均为吸热反应
B.三种化合物中C最稳定
C.加入催化剂会改变反应的焓变
D.整个反应中△H=E1-E2难度: 中等查看答案及解析
-
下列关于有机化合物的结构、性质的叙述正确的是( )
A.苯、油脂均能使酸性KMnO4溶液褪色
B.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
C.蔗糖、麦芽糖的分子式均为C12H22O11,二者互为同分异构体
D.乙醇、乙酸均能与NaOH反应,因为分子中均含有官能团“-OH”难度: 中等查看答案及解析
-
下列有关物质的类属判断合理的是( )
①硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
③棉、麻、羊毛、聚乙烯均属于天然高分子材料
④根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
⑤根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应.
A.只有②④
B.只有②⑤
C.只有①③⑤
D.只有②③④⑤难度: 中等查看答案及解析
-
碳、氮、硫是三种重要的非金属元素,下列有关说法正确的是( )
A.向Na2CO3的饱和溶液中通入过量CO2可以制得NaHCO3晶体
B.N2的化学性质通常非常稳定,但在放电条件下可以与O2反应生成NO2
C.SO2可以使酸性高锰酸钾溶液褪色,体现了其漂白性
D.酸雨的形成跟CO2、NO2、SO2都有关系难度: 中等查看答案及解析
-
下列关于实验操作的叙述正确的是( )
A.证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的淀粉碘化钾试纸检验,观察试纸颜色的变化
B.盛放NaOH溶液时,使用带玻璃瓶塞的磨口瓶
C.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
D.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高难度: 中等查看答案及解析
-
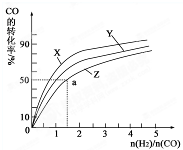
为了探索外界条件对反应:aX(g)+bY(g)⇌cZ(g)的影响,将X和Y以物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示. 下列判断正确的是( )

A.△H<0,a+b>c
B.△H>0,a+b<c
C.△H>0,a+b>c
D.△H<0,a+b<c难度: 中等查看答案及解析
-
关于原子结构、元素性质的说法正确的是( )
A.非金属元素组成的化合物中只含共价键
B.ⅠA金属元素是同周期中金属性最强的元素
C.最外层电子数相同原子的元素在周期表中位于同一族,其元素性质一定相似
D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强难度: 中等查看答案及解析
-
实验室需配制一种仅含五种离子(水电离出的离子可忽略)的混合溶液,且在混合溶液中五种离子的物质的量浓度均为1mol•L-1,下面四个选项中能达到此目的是( )
A.Al3+、K+、SO42-、Cl-、Al[(OH)4]-
B.Fe2+、H+、Br-、NO3-、Cl-
C.Al3+、Na+、Cl-、SO42-、NO3-
D.Na+、K+、SO42-、NO3-、Cl-难度: 中等查看答案及解析
-
下列有关电解质溶液的叙述正确的是( )
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7,c(SO42-)=c(NH4+)
B.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
D.向0.1 mol•L-1的氨水中加入少量硫酸铵固体,则溶液中增大
难度: 中等查看答案及解析
-
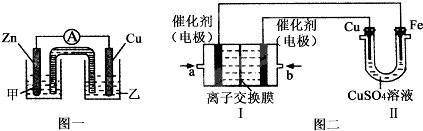
关于下列各装置图的叙述中,不正确的是( )

A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀难度: 中等查看答案及解析
-
在一固定容积的容器中发生反应 N2(g)+3H2(g)═2NH3(g),下列说法正确的是( )
A.容器中气体的压强、密度不再发生变化,均可以说明该反应达到了平衡状态
B.向容器中通入稀有气体He,压强增大,平衡向右移动,反应速率加快
C.如2v正(N2)═v逆(NH3),说明该反应达到了平衡
D.该反应是放热反应,降低温度将缩短反应达到平衡的时间难度: 中等查看答案及解析