-
化学与生产、生活密切相关,下列与化学有关的说法正确的是
A. 胺态氮肥和草木灰混合使用可增加肥效
B. 氢氟酸刻蚀水晶饰品体现其酸性
C. 电渗析法、蒸馏法、离子交换法是海水淡化的常用方法
D. 煤经过气化和液化等物理变化可转为清洁能源
难度: 中等查看答案及解析
-
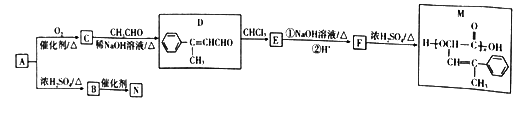
已知:
 ,下列说法正确的是
,下列说法正确的是A. M能发生加聚反应、取代反应和氧化反应
B. M的二氯代物有10种(不考虑立体异构)
C. N中所有碳原子在同一平面上
D. 等物质的量的M、N分别完全燃烧,消耗O2的体积比为4:5
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次减小,其中只有Z为金属元素,X、Y、Z同周期且位于不同奇数族,Z、W同主族,Y、Z的原子序数相差4。下列说法正确的是
A. W的简单阴离子半径一定大于Z的简单阳离子半径
B. 最简单氢化物的稳定性:X—定强于Y
C. Y单质分子的电子式—定为
D. X、W形成化合物的水溶液必须保存在带玻璃塞的细口瓶中
难度: 中等查看答案及解析
-
下列说法正确的是
A. 等质量的铝分别与足量Fe2O3或Fe3O4发生铝热反应时,转移电子的数目相等
B. 质量分数分别为40%和60%的硫酸溶液等体积混合,所得溶液的质量分数为50%
C. 金属钠着火时,立即用泡沫灭火器灭火
D. 洗涤做焰色反应的铂丝,可选用稀盐酸或稀硫酸
难度: 中等查看答案及解析
-
丙烷(C3H8)熔融盐燃料电池和锌蓄电池均为用途广泛的直流电源,放电时二者的总反应分别为C3H8+5O2=3CO2+4H2O,2Zn+O2=2ZnO。用丙烷(C3H8)燃料电池为锌蓄电池充电的装置如图所示,下列说法不正确的是
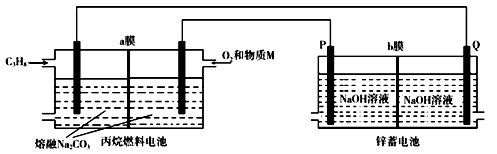
A. 物质M为CO2
B. 燃料电池消耗1mo1 O2时,理论上有4 mol OH-透过b膜向P电极移动
C. a膜、b膜均适宜选择阴离子交换膜
D. 该装置中,锌蓄电池的负极反应式为Zn+2OH--2e-=ZnO+H2O
难度: 中等查看答案及解析
-
下列实验操作和所用装置能达到实验目的的是
选项
A
B
C
D
实验
目的
检验蔗糖与浓硫酸反应产物中有CO2
证明Fe(NO3)2溶液中存在Fe2+的水解平衡
检验某溶液中含有Ag+
比较非金属性:S>C>Si
实验
操作
将浓硫酸滴入圆底烧瓶中,再将生成的气体通入澄清石灰水
将稀硝酸滴入Fe(NO3)2溶液中
向待检液中滴加足量的稀盐酸
将稀硫酸滴入锥形瓶中,再将生成的气体通入Na2SiO3溶液中
所用
装置



A. A B. B C. C D. D
难度: 中等查看答案及解析
-
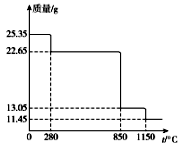
25℃时,用 0.10 mol·L-1的氨水滴定10.0mL a mol • L-1的盐酸,溶液的pH与氨水体积(V)的关系如图所示。已知:N点溶液中存在:c(Cl-)=c(NH4+)+c(NH3·H2O)。下列说法不正确的是
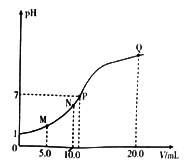
A. a=0.10
B. N、P两点溶液中水的电离程度:N
C. M、N两点溶液中NH4+的物质的量之比大于1:2
D. Q 点溶液中存在:2c(OH-)-2c(H+)=c(NH4+)-c(NH3·H2O)
难度: 困难查看答案及解析


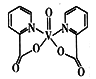 有增强胰岛素和降糖作用,其中所含非金属元素的电负性由小到大的顺序为______(用元素符号表示);氧原子的杂化轨道类型为______________。
有增强胰岛素和降糖作用,其中所含非金属元素的电负性由小到大的顺序为______(用元素符号表示);氧原子的杂化轨道类型为______________。
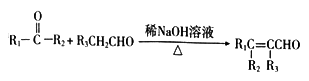 (R1、R2、R3表示烃基或氢原子)
(R1、R2、R3表示烃基或氢原子)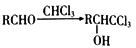 (R表示烃基或氢原子)
(R表示烃基或氢原子)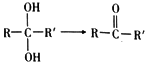 (R和R′表示烃基或H原子)
(R和R′表示烃基或H原子)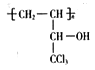 的合成路线________。
的合成路线________。