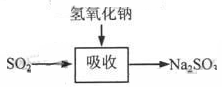
-
2013年4月24日,东航首次成功进行了由地沟油生产的生物航空燃油的验证飞行。能区别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等)的方法是
A.点燃,能燃烧的是矿物油
B.测定沸点,有固定沸点的是矿物油
C.加入水中,浮在水面上的是地沟油
D.加入足量氢氧化钠溶液共热,不分层的是地沟油
难度: 中等查看答案及解析
-
氰酸铵(NH4OCN)与尿素[CO(NH2)2]
A.都是共价化合物 B.都是离子化合物
C.互为同分异构体 D.互为同素异形体
难度: 简单查看答案及解析
-
230Th和232Th是钍的两种同位素,232Th可以转化成233U。下列有关Th的说法正确的是
A.Th 元素的质量数是232 B.Th 元素的相对原子质量是231
C.232Th 转换成233U是化学变化 D.230Th和232Th的化学性质相同
难度: 简单查看答案及解析
-
下列变化需克服相同类型作用力的是
A.碘和干冰的升华 B.硅和C60的熔化
C.氯化氢和氯化钾的溶解 D.溴和汞的气化
难度: 中等查看答案及解析
-
374℃、22.1Mpa以上的超临界水具有很强的溶解有机物的能力,并含有较多的H+和OH-,由此可知超临界水
A.显中性,pH等于7 B.表现出非极性溶剂的特性
C.显酸性,pH小于7 D.表现出极性溶剂的特性
难度: 中等查看答案及解析
-
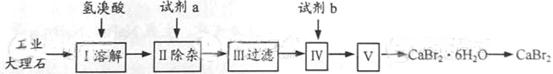
与索尔维制碱法相比,侯德榜制碱法最突出的优点是
A.原料利用率高 B.设备少
C.循环利用的物质多 D.原料易得
难度: 中等查看答案及解析
-
将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y不可能是
选项 X Y
A SO2 H2S
B Cl2 CO2
C NH3 CO2
D SO2 Cl2
难度: 中等查看答案及解析
-
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
A.脱氧过程是吸热反应,可降低温度,延长糕点保质期
B.脱氧过程中铁作原电池正极,电极反应为:Fe-3e→Fe3+
C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e→4OH-
D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况)
难度: 中等查看答案及解析
-
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
A.NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.反应的热化学方程式为:NH4HCO3+HCl→NH4Cl+CO2↑+H2O-Q
难度: 中等查看答案及解析
-
下列关于实验室制备乙酸乙酯和乙酸丁酯的描述正确的是
A.均采用水浴加热 B.制备乙酸丁酯时正丁醇过量
C.均采用边反应边蒸馏的方法 D.制备乙酸乙酯时乙醇过量
难度: 简单查看答案及解析
-
H2S水溶液中存在电离平衡H2S
H++HS-和HS-
H++S2-。若向H2S溶液中
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH值增大
C.滴加新制氯水,平衡向左移动,溶液pH值减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
难度: 中等查看答案及解析
-
根据有机化合物的命名原则,下列命名正确的是
A.
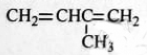 3-甲基-1,3-丁二烯
3-甲基-1,3-丁二烯B.
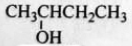 2-羟基丁烷
2-羟基丁烷C.CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷
D.CH3CH(NH2)CH2COOH3-氨基丁酸
难度: 中等查看答案及解析
-
X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子层上s、p电子数相等;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子的M层有1个未成对的p电子。下列有关这些元素性质的说法一定正确的是
A.X元素的氢化物的水溶液显碱性
B.Z元素的离子半径大于W元素的离子半径
C.Z元素的单质在一定条件下能与X元素的单质反应
D.Y元素最高价氧化物的晶体具有很高的熔点和沸点
难度: 困难查看答案及解析
-
为测定镀锌铁皮锌镀层的厚度,将镀锌皮与足量盐酸反应,待产生的气泡明显减少时取出,洗涤,烘干,称重。关于该实验的操作对测定结果的影响判断正确的是
A.铁皮未及时取出,会导致测定结果偏小
B.铁皮未洗涤干净,会导致测定结果偏大
C.烘干时间过长,会导致测定结果偏小
D.若把盐酸换成硫酸,会导致测定结果偏大
难度: 中等查看答案及解析
-
NA代表阿伏伽德罗常数。已知C2H4和C3H6的混合物的质量为ag,则该混合物
A.所含共用电子对数目为(a/7+1)NA B.所含碳氢键数目为aNA/7
C.燃烧时消耗的O2一定是33.6a/14L D.所含原子总数为aNA/14
难度: 中等查看答案及解析
-
已知氧化性Br2>Fe3+。FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:
a Fe2++b Br-+c Cl2→d Fe3++ e Br2+ f Cl-
下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
A.2 4 3 2 2 6 B.0 2 1 0 1 2
C.2 0 1 2 0 2 D.2 2 2 2 1 4
难度: 中等查看答案及解析
-
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中
A.至少存在5种离子
B.Cl-一定存在,且c(Cl?)≥0.4mol/L
C.SO42-、NH4+、一定存在,Cl-可能不存在
D.CO32-、Al3+一定不存在,K+可能存在
难度: 困难查看答案及解析
-
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是
A.生成42.0LN2(标准状况)
B.有0.250molKNO3被氧化
C.转移电子的物质的量为1.25mol
D.被氧化的N原子的物质的量为3.75mol
难度: 中等查看答案及解析
-
部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HCN
H2CO3
电离平衡常数
(25℃)
Ki=1.77×10-4
Ki=4.9×10-10
Ki1=4.3×10-7
Ki2=5.6×10-11
下列选项错误的是
A.2CN-+H2O+CO2→2HCN+CO32-
B.2HCOOH+CO32-→2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
难度: 困难查看答案及解析
-
某恒温密闭容器中,可逆反应A(s)
B+C(g)-Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1
C.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
D.若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q
难度: 困难查看答案及解析
-
一定条件下,将0.1LCO、0.2LCO2、0.1LNO、0.2LNO2和0.2LNH3混合,然后通过分别盛有足量蒸馏水、饱和碳酸氢钠溶液和氢氧化钠溶液的三个洗气瓶(洗气瓶排列顺序不确定)。假设气体通过每个洗气瓶都能充分反应则尾气(已干燥)
A.可能是单一气体 B.不可能含有一氧化碳
C.可能存在原气体中的两种气体 D.成分和洗气瓶的排列顺序无关
难度: 中等查看答案及解析
-
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为
A.9.0L B.13.5L C.15.7L D.16.8L
难度: 中等查看答案及解析
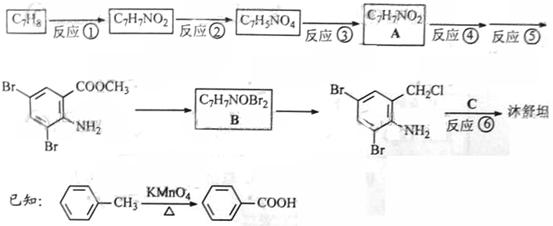
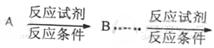 目标产物)
目标产物)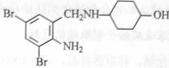 ,不考虑立体异构)是临床上使用广泛的。下图所示的是多条合成路线中的一条(反应试剂和反应条件均未标出)
,不考虑立体异构)是临床上使用广泛的。下图所示的是多条合成路线中的一条(反应试剂和反应条件均未标出)