-
吃大闸蟹是一种季节性享受,李白曾作诗:“蟹螯即金液,糟丘是蓬莱。且须饮美酒,乘月醉高台”。清蒸大闸蟹由青色变成红色,一同学认为这种红色物质可能象酸碱指示剂一样,遇到酸或碱颜色会发生改变。就这位同学的看法而言,这应该属于科学探究中的
A.实验 B.假设 C.观察 D.分类
难度: 简单查看答案及解析
-
将一小块钠投入MgCl2溶液中,下列对有关实验结果的预测正确的是
A.钠溶解,底部有银白色金属析出,并且有气体产生
B.只有气体产生
C.只有沉淀产生
D.既有沉淀产生,又有气体产生
难度: 中等查看答案及解析
-
下列化学实验操作或事故处理方法正确的是
A.实验做完后,直接用嘴吹灭酒精灯
B.浓硫酸沾到皮肤上时,立即用湿抹布冲洗,然后涂上3%~5%的NaOH溶液
C.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸
难度: 中等查看答案及解析
-
如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是
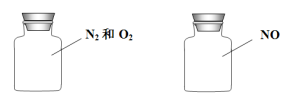
A.所含原子数相等 B.气体密度相等
C.气体质量相等 D.摩尔质量相等
难度: 中等查看答案及解析
-
下列除杂所选用的试剂(括号内为杂质)及操作方法均正确的一组是
选项 待提纯的物质 选用的试剂 操作方法
A NaOH(Na2CO3) 盐酸 -
B CO2(CO) 氧气 加热
C Fe(Zn) FeSO4溶液 过滤
D NaCl(Na2SO4) BaCl2溶液 分液
难度: 中等查看答案及解析
-
(原创)下列叙述中正确的是
A.由HgCl2生成Hg2Cl2时,汞元素被还原
B.铁高温下与水蒸气反应,氧化产物为Fe2O3
C.阳离子只有氧化性,阴离子只有还原性
D.非标况下,1 mol H2的体积不可能为22.4 L
难度: 中等查看答案及解析
-
下列反应中属于氧化还原反应,又是离子反应的是
A.铁和稀硫酸反应 B.碳和氧化铁高温反应
C.氢气在氧气中燃烧生成水 D.氧化铁与盐酸反应
难度: 中等查看答案及解析
-
从硫元素的化合价态上判断,下列物质中的硫元素不能表现氧化性的是
A.Na2S B.S C.SO2 D.H2SO4
难度: 中等查看答案及解析
-
下列物质的保存方法正确的是
A.少量金属钠保存在四氯化碳中
B.氢氧化钠溶液盛放在带有橡胶塞的玻璃试剂瓶中
C.碳酸钠固体保存在细口瓶中
D.白磷保存在干燥的空气中
难度: 中等查看答案及解析
-
下列叙述正确的是
A.NaCl溶液在电流作用下电离成Na+与Cl-
B.溶于水后能电离出H+ 的化合物都是酸
C.氯化氢溶于水能导电,但液态氯化氢不能导电
D.导电性强的溶液里自由移动离子数目一定比导电性弱的溶液里自由移动离子数目多
难度: 中等查看答案及解析
-
从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O,与上述反应在氧化还原原理上最相似的反应是
A.2NaBr+Cl2=2NaCl+Br2
B.2KMnO4
K2MnO4+MnO2+O2 ↑
C.2H2S+SO2=3S ↓+2H2O
D.2FeCl3+H2S=2FeCl2+S ↓+2HCl
难度: 中等查看答案及解析
-
(原创)在遇铝粉能产生大量气体的溶液中,可能大量共存的是
A.Fe2+、Cl-、NO3-、CH3COO- B.Na+、Ca2+、Cl-、CO32-
C.Na+、SO42-、NH4+、HCO3- D.Na+、K+、NO3-、CO32-
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.澄清的石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O
B.钠与水的反应Na+2H2O=Na++2OH -+ H2 ↑
C.硫酸氢钠溶液与少量氢氧化钡溶液混合:2H++SO42-+ Ba2++2OH-= BaSO4↓+2H2O
D.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O
Fe(OH)3↓+3H+
难度: 中等查看答案及解析
-
能把Na2SO4、NH4NO3、KCl、(NH4)2SO4四瓶无色溶液加以区别的一种试剂是(必要时可加热)
A.BaCl2 B.NaOH C.Ba(OH)2 D.AgNO3
难度: 中等查看答案及解析
-
Mg、Al两种金属分别跟同体积、同浓度的稀H2SO4反应,同温同压下生成氢气的体积相同,则Mg、Al两种金属之间的量的关系一定正确的是
A.两个反应电子转移的数目相等 B.加入镁、铝质量比为4∶3
C.金属溶解的物质的量相等 D.加入的两种金属质量不等
难度: 中等查看答案及解析
-
在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O。从而可知在RO3n-中,元素R的化合价是
A.+4 B.+5 C.+6 D.+7
难度: 中等查看答案及解析