-
下列叙述正确的是
A. FeCl2有氧化性,能用于雕刻电路板
B. 金刚石是自然界中硬度最大的物质,不与氧气发生反应
C. 明矾加入水中能形成Al(OH)3胶体,可用作净水剂
D. SiO2不与强酸反应,可用石英器皿盛装氢氟酸
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的数值。下列有关叙述正确的是
A. pH=1的硫酸溶液中含有的SO42-数目为0.05NA
B. 100g质量分数为46%的乙醇溶液中所含的氢原子数为12NA
C. 100mL 1mol/L CH3COONH4 溶液中含有的NH4+数目为0.1NA
D. 0.2molNH3与0.3molO2在催化剂的作用下加热充分反应,所得NO的分子数为0.2NA
难度: 简单查看答案及解析
-
下列关于有机物的说法正确的是
A. 乙醇、乙酸均能与NaOH溶液反应 B. 糖类、油脂、蛋白质均能发生水解反应
C. 通过乙烯的取代反应可制得氯乙烷 D. C4H8Cl2有9种同分异构体
难度: 中等查看答案及解析
-
下列实验操作能达到相应实验目的的是
选项
实验目的
实验操作
A
证明还原性:I->Fe2+
向FeI2和KSCN混合溶液中滴入少量氯水,再加入CCl4,振荡
B
制备Fe(OH)3胶体
向饱和FeCl2溶液中滴加氨水并不断搅拌
C
分离苯和四氯化碳
用分液漏斗进行分液
D
制取NH3
直接加热NH4Cl固体,用向下排空气法收集气体
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在微生物作用下电解有机废水(含CH3COOH),可获得清洁能源H2,其原理如图所示,下列有关说法不正确的是
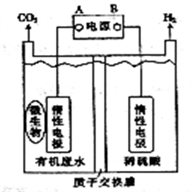
A. 电极B极为负极
B. 与电源A极相连的惰性电极上发生的反应为:CH3COOH-8e-+H2O=2CO2↑+8H+
C. 通电后,H+通过质子交换膜向右移动,最终右侧溶液PH减小
D. 通电后,若有0.1molH2生成,则转移0.2mol电子
难度: 中等查看答案及解析
-
298K时,向体积均为15.0mL,浓度均为1.00mol/L的氨水和NaHCO3溶液中分别滴加1.00mol/L的盐酸,溶液的pH与所加盐酸体积的关系如图所示。下列有关叙述正确的是

A. 曲线a是NaHCO3溶液的滴定曲线
B. 当V(盐酸)=4.00mL时,c(HCO3-)>c(NH4+)>c(CO32-)
C. 当V(盐酸)=15.00mL时,c(Na+)=c(NH4+)
D. 两个滴定过程均可选择酚酞作指示剂
难度: 中等查看答案及解析
-
X、Y、Z、W、R为原子序数依次增大的短周期元素。化合物甲由X、Z、W三种元素组成,常温下0.1mol/L甲溶液的pH=13。工业上常通过电解饱和WR溶液制得甲。Y的单质与由Y、Z组成的化合物之间的转化关系如图。下列叙述正确的是

A. 简单离子的半径:W>Z>R
B. XR与XRZ均为强酸
C. 化合物W2Z3中既含离子键又含极性键
D. 图中转化过程发生的反应均为化合反应
难度: 中等查看答案及解析

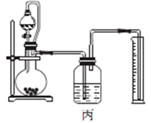
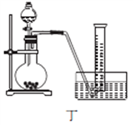




 。
。 、
、 为起始原料(无机试剂任选)制备
为起始原料(无机试剂任选)制备 的合成路线:__________________。
的合成路线:__________________。