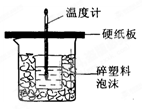
-
下列叙述错误的是( )
A.物质的量是国际单位制中七个基本物理量之一
B. 0.016kg16O 含有约6.02×1023个氧原子
C.单位物质的量的任何物质都含有约6.02×1023个原子
D.一定温度、压强下,气体体积由其分子数目的多少决定
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.1 mol H2O的质量为18g/mol B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g D.标准状况下,1 mol任何物质体积均为22.4L
难度: 中等查看答案及解析
-
科学家已发现一种新型氢分子,其化学式为H3,在相同条件下,等质量的H3和H2具有相同的( )
A.原子数 B.分子数 C.体积 D.物质的量
难度: 中等查看答案及解析
-
已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是( )
A.16g/mol B.28g/mol C.64g /mol D.32g/mol
难度: 中等查看答案及解析
-
下列两种气体的分子数一定不相等的是( )
A.质量相等密度不等的N2和C2H4 B.等体积等密度的CO和C2H4
C.等温、等压,等体积的O2和N2 D.标准状况下,等质量的NO和CO
难度: 中等查看答案及解析
-
用NA表示阿佛加德罗常数,下列叙述正确的是( )
A.在标准状况下,22.4L SO3中所含分子数为NA
B.46gNO2和N2O4的混合物中含有的原子总数一定是3NA
C.在标准状况下,含NA个氦原子(He)的氦气所含的分子数是0.5NA
D.2.24LN2和O2的混合气体所含原子数为0.2NA
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.1mol甲醇中含有C-H键的数目为4NA
B.25℃,PH=13的NaOH溶液中含有OH-的数目为0.1NA
C.标准状况下,2.24L已烷含有分子的数目为0.1NA
D.常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4 NA
难度: 中等查看答案及解析
-
在4℃时, 100mL水中溶解了22.4LHCl气体(标况)后形成的溶液。下列说法中正确的( )
A.该溶液物质的量浓度为10mol·L-1
B.所得溶液的体积约为22.5L
C.该溶液物质的量浓度因溶液的密度未知而无法求得
D.该溶液中溶质的质量分数因溶液的密度未知而无法求得
难度: 中等查看答案及解析
-
欲配制100ml 1.0 mol/L Na2SO4溶液,正确的方法是( )
① 将14.2 g Na2SO4 溶于100ml水中
② 将32.2g Na2SO4·10H2O溶于少量水中,再用水稀释至100 ml
③ 将20 ml 5.0 mol/L Na2SO4溶液用水稀释至100 ml
A.①② B.②③ C.①③ D.①②③
难度: 中等查看答案及解析
-
20℃时,饱和KCl溶液的密度为1.174g·cm-3,物质的量浓度为4.0mol·L-1,则下列说法中正确的是( )
A.将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174 g·cm-3
B.此溶液中KCl的质量分数为
C.密度大于1.174 g·cm-3的KCl溶液是过饱和溶液
D.25℃时,饱和KCl溶液的浓度大于4.0 mol·L-1<
难度: 中等查看答案及解析
-
分类是化学学习和研究中常用的思维方法,下列关于化学物质和反应类型关系正确的是( )
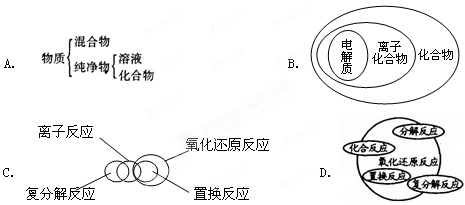
难度: 中等查看答案及解析
-
关于胶体和溶液的区别,下列叙述中正确的( )
A.溶液呈电中性,胶体带电荷
B.溶液中通过一束光线出现明显光路,胶体中通过一束光线没有特殊现象
C.溶液中溶质粒子能通过滤纸,胶体中分散质粒子不能通过滤纸
D.溶液与胶体的本质区别在于分散质微粒直径大小,前者小于1nm,后者介于1nm和100nm之间
难度: 中等查看答案及解析
-
下列反应中气体只作氧化剂的是( )
A.Cl2通入水中 B.Cl2通入Na2SO3水溶液中
C.二氧化硫通入氯水中 D.NO2通入水中
难度: 中等查看答案及解析
-
将氯气分别通入含有下列离子的溶液中,其中的离子不发生变化的是( )
A.SO42- B.Fe2+ C. S2- D.OH-
难度: 中等查看答案及解析
-
11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4反应中,被氧化的P原子与被还原的P原子个数比是( )
A.6:5 B.5:6 C.11:5 D.11:6
难度: 中等查看答案及解析
-
根据以下反应①
②
, 判断:
氧化性强弱的顺序是 ( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
溴化碘(IBr)的化学性质跟卤素单质相似,它跟水反应的化学方程式为: IBr + H2O = HBr + HIO,下列有关的叙述中,不正确的是( )
A.IBr是双原子分子 B.在很多反应中,IBr是氧化剂
C.和NaOH溶液反应生成NaBr D. 和H2O反应时,IBr既是氧化剂又是还原剂18.南方都市报06
难度: 中等查看答案及解析
-
“灰霾加重光化学烟雾污染 珠三角臭氧浓度严重超标” 光化学烟雾主要有害物质是O3。它是由排放到大气中的氮的氧化物和碳氢化合物等在阳光照射下,发生光化学反应而形成的污染物。O3有较强的氧化性,有关反应的化学方程式为:O3+2KI+H2O = 2KOH+I2+O2 ,下列说法不正确的是( )
A.城市中的氮的氧化物和碳氢化合物主要是汽车排出的废气造成
B.根据O3和KI溶液反应反可知,有1molO3参加反应,转移电子为6mol
C.光化学污染属二次污染。
D.O3和KI溶液反应中O2既不是氧化产物又不是还原产物
难度: 中等查看答案及解析
-
某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO-3的浓度比为1∶3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为 ( )
A. 21∶5 B. 11∶3 C. 3∶1 D. 4∶1
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.氯化钾溶液在电流作用下电离成钾离子和氯离子
B.二氧化硫溶于水能部分转化成离子,故二氧化硫属于弱电解质
C.硫酸钡难溶于水,所以硫酸钡属弱电解质
D .纯净的强电解质在液态时,有的导电有的不导电
难度: 中等查看答案及解析
-
下列离子方程式中,正确的是( )
A.水玻璃中通入足量的CO2:
+2CO2+2H2O==H2SiO3 (胶体)+2CO
B.氯化亚铁溶液中通入足量的Cl2:2Fe2++Cl2==2Fe3++2Cl-
C.NaHCO3溶液中加入足量NaHSO4溶液: 2H++CO
==CO2↑+H2O
D.碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH- =CaCO3↓+H2O
难度: 中等查看答案及解析
-
下列离子在酸性溶液中能大量共存的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列关于能量变化的说法正确的是( )
A.“冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高
B.化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种
C.已知C(石墨,s)===C(金刚石,s ) ΔH>0,则金刚石比石墨稳定
D.化学反应遵循质量守恒的同时,也遵循能量守恒
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C 的燃烧热为110.5 kJ/mol
B.在101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量,则H2的燃烧热为-285.8 kJ/mol
C.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度
D.在稀溶液中:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ
难度: 中等查看答案及解析
-
已知(1)H2(g)+1/2O2(g)===H2O(g) △H1=a kJ·mol-1
(2)2H2(g)+O2(g)===2H2O(g) △H2=b kJ·mol-1
(3)H2(g)+1/2O2(g)===H2O(l) △H3=c kJ·mol-1
(4)2H2(g)+O2(g)===2H2O(l) △H4=d kJ·mol-1
下列关系式中正确的是:( )
A.a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
难度: 中等查看答案及解析