-
把0.05 mol NaOH固体分别加入到100 mL下列液体中,溶液的导电能力变化最小的是
A.自来水 B.0.5 mol·L-1盐酸溶液
C.0.5 mol·L-1CH3COOH溶液 D.0.5 mol·L-1 KCl溶液
难度: 简单查看答案及解析
-
下列关于吸热反应和放热反应的说法正确的是
A.需加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件一定能发生
C.反应物和生成物分别具有的总能量决定了反应是放热反应还是吸热反应
D.当ΔH<0时表明反应为吸热反应
难度: 简单查看答案及解析
-
已知:H2(g)+F2(g)===2HF(g) 的能量变化如图所示,下列有关叙述中正确的是
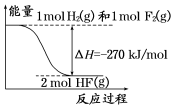
A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D.断裂1 mol H—H键和1 mol F—F 键吸收的能量大于形成2 mol H—F键放出的能量
难度: 中等查看答案及解析
-
改变外界条件可以影响化学反应速率,针对H2(g)+I2(g)
2HI(g),其中能使活化分子百分数增加的是
①增加反应物浓度 ②增大气体的压强 ③升高体系的温度 ④使用催化剂
A.①② B.②③ C.①④ D.③④
难度: 中等查看答案及解析
-
在恒温、容积为2L的密闭容器中充入2mol SO2和一定量O2。发生反应2SO2+O2
2SO3,当反应进行到4min时,测得n(SO2)=0.4mol。若反应进行到2min时,容器中SO2的物质的量是
A.等于1.6 mol B.等于1.2 mol C.大于1.6 mol D.小于1.2 mol
难度: 中等查看答案及解析
-
一定温度下,两个恒容密闭容器中分别发生反应:
①H2(g)+I2(g)
2HI(g);
②C(s)+H2O(g)
CO(g)+H2(g),下列状态能表明两反应都达到平衡状态的是
a.各物质的浓度不变;
b.容器内气体压强不变;
c.容器内气体密度不变;
d.容器内气体颜色不变;
e.各组分的物质的量分数或质量分数不变;
f.混合气体的平均分子量不变。
A.ae B.aef C.abc D.ac
难度: 中等查看答案及解析
-
在一真空容器中,充入10 mol N2,30 mol H2,发生反应N2(g)+3H2(g)
2NH3(g),在一定条件下达到平衡时,N2的转化率为25%。若在同一容器中,在相同温度下,向容器中充入NH3,欲使达到平衡时各成分的质量分数与上述平衡相同,则起始时NH3的量和达到平衡时NH3的转化率为
A.20 mol、25% B.20 mol、75% C.40 mol、30% D.10mol、50%
难度: 困难查看答案及解析
-
有一可逆反应2A(g)+3B(g)
4C(g)+D(g),已知起始浓度c(A)=2mol/L,c(B)=3mol/L,c(C)=c(D)=0,反应开始20min后达到平衡状态,此时D的平衡浓度为0.5mol/L,则下列说法不正确的是
A.前20 min的平均反应速率v(C)=0.1 mol/(L•min) B.A的转化率为50%
C.C的平衡浓度c(C)=4 mol/L D.B的平衡浓度c(B)=1.5 mol/L
难度: 中等查看答案及解析
-
反应X(g)+Y(g)
2Z(g) ΔH<0,达到平衡时,下列说法正确的是
A.减小容器体积,平衡向右移动 B.加入催化剂,Z的产率增大
C.增大c(X),X的转化率增大 D.降低温度,Y的转化率增大
难度: 简单查看答案及解析
-
已知:
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是:
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.
H2SO4(aq)+
Ba(OH)2(aq)=
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H
2O(l) ΔH=+135.9 kJ·mol-1
难度: 中等查看答案及解析
-
将浓度为0.1mol/LHF溶液加水不断稀释,下列各量始终保持增大的是
A.c(H+) B.Ka(HF) C.
D.
难度: 中等查看答案及解析
-
对室温下100mL pH=2的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
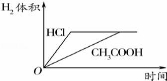
A.加水稀释至溶液体积为200mL,醋酸溶液的pH变为4
B.温度都升高20°C后,两溶液的pH不再相等
C.加水稀释至溶液体积为200mL后,两种溶液中c(OH﹣)都减小
D.加足量的锌充分反应后,两溶液中产生的氢气体积可用上图表示
难度: 中等查看答案及解析
-
已知水在25℃和95℃时,其电离平衡曲线如图所示,下列说法错误的是
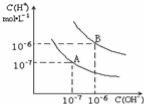
A.95℃时,pH=4的H2SO4溶液中,由水电离出的c(OH-)=1×10-10mol/L
B.15℃时,pH=7的溶液呈酸性
C.AB连线上的点均表示中性溶液
D.B点对应的温度高于A点对应的温度
难度: 中等查看答案及解析
-
等量的苛性钠溶液分别用pH值为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va和Vb,则它们之间的关系是
A.Va>10Vb B.Vb=10Va C.Va<10Vb D.Vb>10Va
难度: 困难查看答案及解析
-
在一定温度下,固定容积的容器中加入a mol A和b mol B,发生反应:
A(g)+2B(g)
2C(g)一段时间后达到平衡,生成n mol C。则下列说法中不正确的是
A.再充入少量A,平衡向正反应方向移动,但K值不变
B.起始时刻和达到平衡后容器中的压强之比为(a+b):(a+b﹣
)[
C.当2v正(A)=v逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar)增大压强,平衡向正反应方向移动
难度: 困难查看答案及解析
-
对于密闭容器中的可逆反应:4L(g)
2M(g)+N(g) △H>0,其平衡状态与温度(T)和压
强(P1>P2)的关系如图所示。图中y轴是指
A.气体混合物的平均相对分子质量 B.气体混合物的总物质的量浓度
C.L在气体混合物的体积分数 D.气体混合物的密度
难度: 中等查看答案及解析
-
下列事实中,不能用勒夏特列原理解释的是
A.冰镇的啤酒打开后泛起泡沫
B.由H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
C.工业制取金属钾Na(l)+KCl(l)
NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
D.黄绿色的氯水光照后颜色变浅
难度: 简单查看答案及解析
-
一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)
CO(g)+3H2(g),设起始
=Z,在恒压下,平衡时
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
A.该反应的焓变△H>0
B.图中Z的大小为a>3>b
C.图中X点对应的平衡混合物中
=3
D.温度不变时,图中X点对应的平衡在加压后
(CH4)减小
难度: 困难查看答案及解析
-
某小组为了研究电化学原理设计了如图所示的装置,下列说法中错误的是
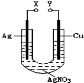
A.X和Y不连接时,铜棒上会有金属银析出
B.X和Y用导线连接时,银棒是正极,发生氧化反应
C.若X接直流电源的正极,Y接负极,Ag+向铜电极移动
D.无论X和Y是否用导线连接,铜棒均会溶解,溶液都从无色逐渐变成蓝色
难度: 中等查看答案及解析
-
某学习小组的同学查阅相关资料知氧化性:Cr2O72->Fe3+,设计了盐桥式的原电池,见下图。盐桥中装有琼脂与饱和K2SO4溶液。下列叙述中正确的是
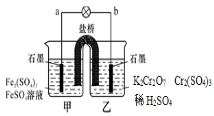
A.甲烧杯的溶液中发生还原反应
B.乙烧杯中发生的电极反应为:2Cr3++7H2O - 6e- = Cr2O72-+14H+
C.外电路的电流方向是从b到a
D.电池工作时,盐桥中的SO42-移向乙烧杯
难度: 困难查看答案及解析
-
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。电解质溶液为KOH溶液,电池反应为:
Cd+2NiO(OH)+2H2O
Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是
A.充电过程是化学能转化为电能的过程
B.充电时阳极反应为Cd(OH)2+2e—== Cd + 2OH -
C.放电时电池内部OH - 向正极移动
D.充电时与直流电源正极相连的电极上发生Ni(OH)2转化为NiO(OH)的反应
难度: 中等查看答案及解析
-
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
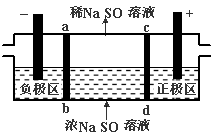
A.通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2 H2O-4e–=O2+4H+,负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
难度: 极难查看答案及解析
-
如图装置中,有如下实验现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释不合理的是
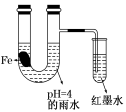
A.生铁片中所含的碳能增
强铁的抗腐蚀性
B.雨水酸性较强,生铁片开始发生析氢腐蚀
C.导管内墨水液面
回升时,正极反应式:O2+2H2O+4e—==4OH-
D.随着反应的进行,U型管中雨水
的酸性逐渐减弱
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是
A.用CH3COOH溶液做导电实验,灯泡很暗,证明CH3COOH是弱电解质
B.pH相同的醋酸和盐酸,取等体积的两种酸溶液分别稀释至原溶液体积的m倍和n倍,稀释后两溶液的pH仍然相同,则m<n
C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小且c(NH4+)/c(NH3·H2O)的值增大
D.常温下,CH3COOH的Ka=1.7×10-5,NH3·H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3·H2O的溶液中的c(OH-)相等
难度: 困难查看答案及解析