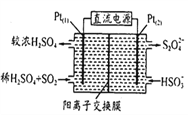
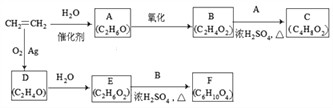
-
原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是( )
A. 元素的非金属性次序为c>b>a B. a和其他3种元素均能形成共价化合物
C. d和其他3种元素均能形成离子化合物 D. 元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
难度: 困难查看答案及解析
-
化学与生活密切相关,下列有关说法正确的是( )
A. 聚乙烯塑料的老化是由于发生了加成反应
B. 稀的食盐水能杀死H7N9禽流感病毒
C. 涂改液中常含有三氯甲烷,用作溶剂,学生要少用,因为三氯甲烷有毒难挥发
D. 丙三醇俗称甘油,可用作冬天干燥天气的护肤品,因为它具有吸湿性
难度: 中等查看答案及解析
-
下列各有机物的名称肯定错误的是( )
A. 3-甲基-2-戊烯 B. 3-甲基-2-丁烯
C. 2,2—二甲基丙烷 D. 3-甲基-1-丁烯
难度: 中等查看答案及解析
-
用NA表示阿伏德罗常数,下列叙述正确的是( )
A. 标准状况下,22.4LH2O含有的分子数为1 NA
B. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C. 通常状况下,1 NA个CO2分子占有的体积为22.4L
D. 在0.5mol/L的Mg SO4溶液中,Mg2+数目为0.5 NA
难度: 中等查看答案及解析
-
常温下,在pH=5的CH3COOH溶液中存在如下电离平衡:CH3COOH
CH3COO-+H+,对于该平衡,下列叙述正确的是
A.加入水时,平衡向右移动,CH3COOH电离常数增大
B.加入少量CH3COONa固体,平衡向右移动
C.加入少量NaOH固体,平衡向右移动,c(H+)减小
D.加入少量pH=5的硫酸,溶液中c(H+)增大
难度: 中等查看答案及解析
-
下列不属于盐类水解反应离子方程式的是
A.HCO3-+H2O
H3O++CO32- B.CH3COO- +H2O
CH3COOH + OH-
C.CO32-+H2O
HCO3-+ OH- D.Al3++3H2O
Al(OH)3 +3H+
难度: 中等查看答案及解析
-
反应2A(g)⇌2B(g)+C(g);△H>0,达平衡时,要使v正降低、c(A)增大,应采取的措施是( )
A. 加压 B. 减压 C. 减小A的浓度 D. 降温
难度: 中等查看答案及解析
-
下列化合物的一氯代物的数目大小排列顺序正确的是( )
①CH3CH2CH2CH2CH2CH3②(CH3)2CHCH(CH3)2③(CH3)3CCH2CH3④(CH3)3CC(CH3)3
A. ①>②>③>④ B. ③=①>②>④ C. ③>②>④>① D. ②>③=①>④
难度: 中等查看答案及解析
-
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是
A. 简单离子半径:W<X<Z
B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的热稳定性:W<Y
D. 最高价氧化物的水化物的酸性:Y>Z
难度: 困难查看答案及解析
-
下列有关电解质溶液的叙述正确的是
A. 同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7
B. 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
C. 含1 mol KOH的溶液与1 mol CO2完全反应后,溶液中c(K+)=c(HCO3-)
D. 在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-)
难度: 中等查看答案及解析
-
下列热化学方程式表达正确的是(
的绝对值均正确)
A. C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) △H=–1367.0 kJ/mol(燃烧热)
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H= +57.3kJ/mol(中和热)
C. S(s)+O2(g)=SO2(g) △H=–269.8kJ/mol (反应热)
D. 2NO2=O2+2NO △H= +116.2kJ/mol (反应热)
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是 ( )
A. 以石墨为电极电解MgCl2溶液:2Cl—+2H2O
Cl2+H2↑+2OH—
B. CuC12溶液中加入氨水:Cu2++2OH- Cu(OH)2↓
C. KI溶液中滴入稀硫酸,空气中振荡:4H++4I-+O2 2I2+2H2O
D. 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH
+OH-
NH3↑+H2O
难度: 中等查看答案及解析
-
下列4组实验操作或装置图(略去部分夹持仪器)中,有错误的图有( )个
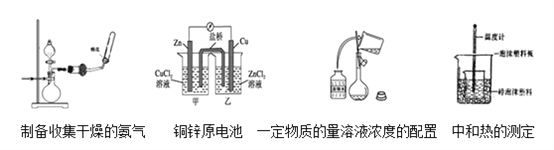
A. 1 B. 2 C. 3 D. 4
难度: 中等查看答案及解析
-
某有机物的结构为
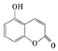 ,下列有关说法正确的是 ( )
,下列有关说法正确的是 ( )A. 1 mol该物质与足量浓溴水反应,最多消耗2 molBr2
B. 1mol该物质最多能与2mol NaOH反应
C. 1 mol该物质最多能与3 mol H2加成
D. 该物质的核磁共振氢谱共有6个吸收峰
难度: 中等查看答案及解析
 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。