-
下列各组离子可能大量共存的是( )
A.含有大量NO3-的澄清透明溶液中:K+、Cu2+、Cl-、Na+
B.能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、NH4+
C.常温下水电离出的c(H+)•c(OH-)=10-20的溶液中:Na+、HCO3-、SO42-、Cl-
D.pH=7的溶液:Fe3+、Mg2+、SO42-、Cl-难度: 中等查看答案及解析
-
2008年的诺贝尔化学奖被三位科学家(见图)共同获得,以表彰他们在“发现和研究
绿色荧光蛋白(green fluorescent protein 简称GFP)方面做出的贡献”.GFP需要在氧化状态下产生荧光,强化还原剂能使GFP转变为非荧光形式,但一旦重新暴露在空气或氧
气中,GFP荧光便立即得到恢复.下列说法不正确的是( )
A.GFP是有氨基酸构成的能发出荧光的一类特殊蛋白质
B.可用GFP标记需要研究的蛋白质,研究特定的反应
C.GFP的发光是将化学能转化为光能
D.GFP产生荧光不受外界环境影响难度: 中等查看答案及解析
-
下列药品保存方法正确的是( )
A.白磷保存在煤油中
B.在氯化亚铁试剂中加盐酸和铁粉
C.金属钾保存在CCl4中
D.过氧化钠保存配有玻璃塞的广口试剂瓶中难度: 中等查看答案及解析
-
阿伏伽德罗常数约为6.02×1023mol-1,下列叙述正确的是( )
A.8.2 g Na218O2与过量的H216O作用,生成的氧气中含有的中子数为0.8×6.02×1023
B.6.4g CaC2晶体中含有阴阳离子总数为0.3×6.02×1023
C.0.88gC3H8中含有的共价键总数为0.2×6.02×1023
D.7.8g过氧化钠粉末与水反应转移的电子数为0.2×6.02×1023难度: 中等查看答案及解析
-
在大试管内依次加入20mL蒸馏水、10mL无水酒精、7g硫酸铵晶体,充分振荡后静置片刻,形成液体分层、部分固体沉淀的现象; 再用激光笔测试,仅上层液体出现右图所示现象.依据上述描述,判断下列说法错误的是( )
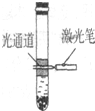
A.硫酸铵的溶解过程属于熵增的过程
B.上层可能是硫酸铵在乙醇中形成的胶体
C.该温度下,硫酸铵在水中的溶解度大于其在乙醇中的溶解度
D.向该试管内滴入甲基橙试剂振荡后静置,上层液体显无色,下层液体出现红色难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.AgNO3溶液中加入过量氨水:Ag++NH3H2O═AgOH↓+NH4+
B.把0.4mol铁粉和0.8mol稀硝酸充分反应:Fe+4H++NO3-═Fe3++NO↑+2H2O
C.高锰酸钾与乙醇制备Mn3O4纳米粉体,同时生成乙醛:
6MnO4-+13CH3CH2OH→2Mn3O4+13CH3CHO+6OH-+10H2O
D.NH4HSO3溶液与足量NaOH溶液也混合:HSO3-+OH-═SO32-+H2O难度: 中等查看答案及解析
-
X、Y、Z、W有如图所示的转化关系,则X、W可能是①C、O2 ②AlCl3、NaOH ③Fe、HNO3 ④S、O2( )
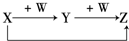
A.①②③
B.①②
C.③④
D.①②③④难度: 中等查看答案及解析
-
早在1807年化学家戴维用电解熔融氢氧化钠制得钠 4NaOH(熔)
4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH
Fe3O4+2H2↑十4Na↑.下列有关说法正确的是( )
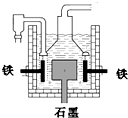
A.电解熔融氢氧化钠制钠,阳极发生电极反应为:2OH--2e-=H2↑+O2↑
B.盖•吕萨克法制钠原理是利用铁的还原性比钠强
C.若戴维法与盖•吕萨克法制得等量的钠,则两反应中转移的电子总数也相同
D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极难度: 中等查看答案及解析
-
“人文奥运、科技奥运、绿色奥运”是2008年北京奥运会的重要特征.其中禁止运动员
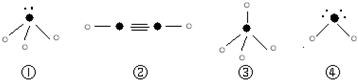
使用兴奋剂的重要举措之一.其中一种兴奋剂X的结构如图所示.下列说法不正确的是( )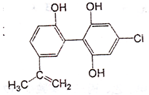
A.1molX与足量NaOH溶液反应,最多消耗3molNaOH
B.1molX 与足量浓溴水反应,最多消耗3molBr2
C.X遇FeCl3溶液显色,属于苯酚的同系物
D.兴奋剂X所有碳原子有可能共平面难度: 中等查看答案及解析
-
下列有关金属腐蚀与防护的说法正确的是( )
A.纯银器表面在空气中因化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀难度: 中等查看答案及解析
-
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
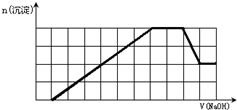
A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B.原溶液中一定含有SO42-和Na+
C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D.反应最后形成的溶液中含有的溶质为Na2SO4难度: 中等查看答案及解析
-
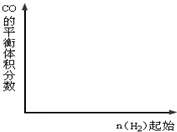
在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的物质的量为0.5mol.则下列说法正确的是( )
A.800℃下,该反应的化学平衡常数为0.25
B.427℃时该反应的平衡常数为9.4,则该反应的△H<0
C.同温下,若继续向该平衡体系中通入1.0 mol的H2O(g),则平衡时CO转化率为66.7%
D.同温下,若继续向该平衡体系中通入1.0 mol的CO(g),则平衡时CO物质的量分数为33.3%难度: 中等查看答案及解析
-
已知25℃时有关弱酸的电离平衡常数:则下列有关说法正确的是( )
弱酸化学式 CH3COOH HCN H2CO3 电离平衡常数(25℃) 1.8×10-5 4.9×l0-10 K1=4.3×10-7 K2=5.6×10-11
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol•L-1 HCN溶液与b mol•L-1NaOH溶液等体积混合后,溶液中c(Na+)>c(CN-),则a一定小于b
C.冰醋酸中逐滴加水,则溶液的导电性、n(H+)、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,存在c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)难度: 中等查看答案及解析
-
多硫化钠Na2Sx(x≥2)在结构上与Na2O2、FeS2、CaC2等有相似之处.Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,反应中Na2Sx与NaClO的物质的量之比为1:16,则x的值是( )
A.5
B.4
C.3
D.2难度: 中等查看答案及解析
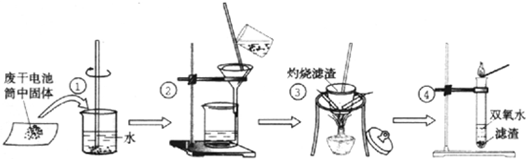
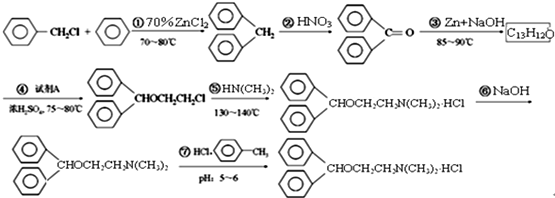
 请在括号中填写加工方法或操作名称______、______.
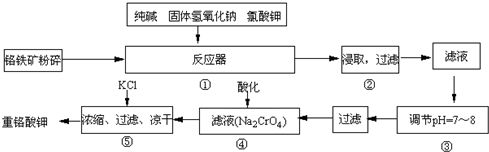
请在括号中填写加工方法或操作名称______、______.