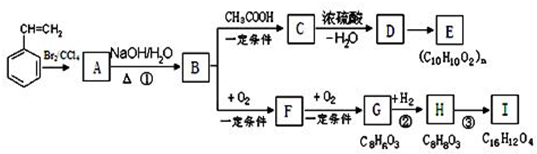
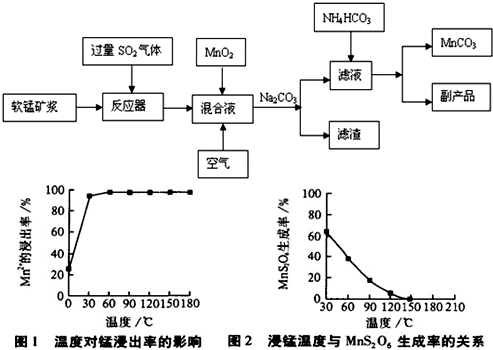
-
有A、B、C、D四种金属.将A与B用导线连接起来浸入电解质溶液中,B不易腐蚀.将A、D分别投入等浓度盐酸溶液中,D比A反应剧烈.将铜浸入B的盐溶液中,无明显变化.如果把铜浸入C的盐溶液中,有金属C析出.据此判断它们的活动性由强到弱的顺序是( )
A.D>C>A>B
B.D>A>B>C
C.D>B>A>C
D.B>A>D>C难度: 中等查看答案及解析
-
关于浓度均为0.1mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是( )
A.c(NH+4):③>①
B.水电离出的c(H+):②>①
C.①和②等体积混合的溶液:c(H+)=c(OH-)+c
D.①和③等体积混合后的溶液:c(NH+4)>c(Cl-)>c(OH-)>c(H+)难度: 中等查看答案及解析
-
电子层数相同的短周期元素X、Y、Z、W,其中X的最外层电子数比K层少1,Y的最外层电子数比K层多l,Z的单质是一种半导体材料,常用于制造太阳能电池,W的原子半径 是同周期中最小的.下列推断中正确的是( )
A.Z的氢化物的热稳定性强于w的氢化物
B.Z的氧化物与水反应可制得相应的含氧酸
C.X、Y、W的原子半径依次减小,对应的离子半径依次增大
D.X、Y、W的最高价氧化物对应水化物之间互相都能发生反应难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述中正确的是( )
A.常温下11.2L的甲烷气体含有甲烷分子数为0.5NA个
B.常温下14g乙烯和丙烯的混合物中总原子数为3NA个
C.标准状况下,11.2LSO3中含有个0.5NA个SO3分子
D.1.5molNO2与足量水反应,转移的电子数为1.5NA难度: 中等查看答案及解析
-
下列实验原理、装置、试剂选用、结论正确的是( )

A.用湿润的pH试纸测定稀盐酸的pH
B.用下图1构成锌-铜原电池
C.用下图2根据有关实验现象推知酸性:CH3COOH>H2CO3>C6H5OH
D.用下图3验证溴乙烷发生消去反应生成烯烃难度: 中等查看答案及解析
-
下列离子方程式中,正确的是( )
A.Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑
B.向稀硝酸中加入少量铁粉:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
C.氯化镁溶液与氨水反应:Mg2++2OH-=Mg(OH)2↓
D.向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O难度: 中等查看答案及解析
-
化合物M叫假蜜环菌甲素,它是香豆素类天然化合物.对M的性质叙述正确的是( )

A.M与Br2能发生取代反应,也能发生加成反应
B.M的化学式为C12H9O5
C.M可溶于NaOH稀溶液,1molM最多消耗3mol NaOH
D.1molM在催化剂作用下最多能与4molH2发生加成反应难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.铅蓄电池在放电过程中,负极质量减小,正极质量增加
B.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0
C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D.相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱难度: 中等查看答案及解析