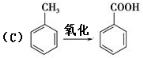
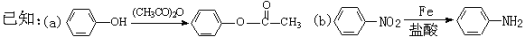-
化学与人类生活密切相关,下列与化学有关的说法正确的是
A.制饭勺、饭盒、高压锅等的不锈钢是合金
B.做衣服的棉和麻均与淀粉互为同分异构体
C.煎炸食物的花生油和牛油都是可皂化的饱和酯类
D.磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,则下列说法正确的是
A.电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA
B.向NH4Al(SO4)2稀溶液中逐滴加入过量Ba(OH)2溶液,离子方程式为:NH4+ +Al3++2SO42-+ 2Ba2++ 5OH-=2BaSO4↓+ AlO2-+ 2H2O+NH3•H2O
C.常温下,由水电离出的H+浓度为10-13mol·L-1的溶液中,Fe2+、Cl-、Na+、NO3-可能大量共存
D.葡萄糖(C6H12O6)溶液中:SO42-、MnO4-、K+、H+ 可以大量共存
难度: 困难查看答案及解析
-
某有机物T的分子式为C5H12O4,0.1mol T与足量钠反应生成4.48L(标准状况)氢气。已知一个碳原子上连接两个-OH的有机物不稳定。则T的稳定结构(不考虑立体异构)有
A.6种 B.7种 C.8种 D.9种
难度: 困难查看答案及解析
-
S-诱抗素能保持鲜花盛开,S-诱抗素的分子结构,如图,下列关于该物质说法正确的是

A. S-诱抗素能发生酯化反应的官能团有2种
B. S-诱抗素含有苯环、羟基、羰基、羧基、碳碳双键
C. 1 mol S-诱抗素与足量金属Na反应生成0.5 mol H2
D. 该化合物不能发生聚合反应
难度: 中等查看答案及解析
-
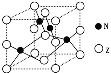
电解法是处理工业废水的一种重要方法。如酸性含(Cr2O72-)废水就可以采用电解法进行无害化处理。电解时采用Fe作阳极,惰性电极作阴极。已知:①氧化性:Cr2O72->Fe3+ ;②Cr2O72-被还原生成Cr3+;③Ksp[Cr (OH)3]=6.3×10-31。下列说法正确的是
A. 阳极材料也可以是Cu
B. 阴极每产生3molH2,则有1mol Cr2O72-被还原
C. 一段时间后溶液中发生反应Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
D. 电解最后阶段需要加碱,使溶液中的阳离子转化为沉淀
难度: 极难查看答案及解析
-
下列说法正确的是
A.制备硫酸亚铁晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液被全部蒸干
B.向1 mL浓度均为0.05 mol·L-1的NaCl、NaI混合溶液中滴加2滴0.01 mol·L-1的AgNO3溶液,振荡,沉淀呈黄色。结论:Ksp(AgCl)<Ksp(AgI)
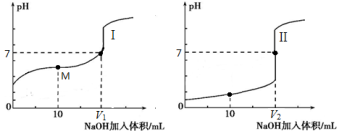
C.0.1mol·L-1的NaOH溶液分别中和pH、体积均相等的醋酸和盐酸,所消耗NaOH溶液的体积:前者小于后者
D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小
难度: 困难查看答案及解析
-
下列关于各实验装置图的叙述中正确的是

A.装置①:构成锌—铜原电池
B.装置②:除去Cl2中含有的少量HCl
C.装置③:验证溴乙烷发生消去反应生成烯烃
D.装置④:由实验现象推知酸性强弱顺序为CH3COOH>H2CO3>C6H5OH
难度: 中等查看答案及解析