-
下列过程不用通电也能进行的是( )
①电离 ②电解 ③电镀 ④电泳 ⑤电化学腐蚀
A. ①⑤ B. ②③④ C. ① D. ①④⑤
难度: 简单查看答案及解析
-
类比推理的方法在化学学习与研究中有广泛的应用;但有时会得出错误的结论。以下几种类比推理结论中正确的是( )
A. CO2通入Ba(NO3)2溶液中无沉淀生成;推出SO2通入Ba(NO3)2溶液中无沉淀生成
B. HCl一定条件下能被MnO2氧化为Cl2;推出HBr一定条件下也能被MnO2氧化为Br2
C. H2O的沸点高于H2S;推出H2S沸点高于H2Se
D. Fe3Cl8可以改写为FeCl2·2FeCl3;推出Fe3I8可以改写为FeI2·2FeI3
难度: 中等查看答案及解析
-
某溶液中含有较多的CuSO4和少量的 Fe2(SO4)3。若用该溶液制取硫酸铜固体;可供选择的操作有:
(1)加适量H2SO4溶液;(2)加适量CuO;(3)冷却结晶;(4)加过量NaOH;(5)加强热至有大量白色固体析出;(6)过滤。正确的操作步骤是( )
A. (2)(6)(3)(6) B. (2)(6)(5)
C. (4)(6)(3)(5) D. (4)(6)(1)(3)
难度: 简单查看答案及解析
-
下列化学用语不正确的是( )
A. 质子数为8、中子数为10的氧原子:
B. 比例模型
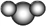 , 不能表示二氧化碳,可以表示水分子
, 不能表示二氧化碳,可以表示水分子C. 碳正离子(CH3+)的电子式为
D. 氨气溶于水使溶液呈碱性:NH3+H2O
NH3·H2O
NH4+ + OH-
难度: 简单查看答案及解析
-
以下操作或结论正确的是( )
A. 将10mL质量分数2%的H2SO4加水至20mL,其质量分数大于1%
B. 称取10.2gNaOH时,将10g的砝码放在右盘,并将游码移到0.2g的位置
C. 将铂丝放在稀硫酸中洗涤并灼烧后,再蘸取待检物进行焰色反应
D. 用试纸检验气体时,应该将气体通向放在表面皿(或玻璃片)上的湿润的试纸
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A. 标况下,11.2 L的HF所含分子数为0.5 NA
B. 制取氢氧化铁胶体时,若有1 mol FeCl3完全水解,则生成NA个胶粒
C. 一定条件下,将1g苯乙烯溶于12g苯,所得混合物中含有的碳原子数为NA
D. 133.5 g氯化铝固体中含有NA个铝离子
难度: 中等查看答案及解析
-
宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载;“银针验毒”的原理是4Ag+2H2S+O2=2X+2H2O;下列说法正确的是( )
A. 反应中还原剂是Ag和H2S,氧化剂是O2
B. 每生成1mol X,反应转移2mol e-
C. 《洗冤集录》中应当还记载有变黑银针放入盛有食盐水的铝盆中而复原的方法。
D. 上述验毒反应的氧化产物和还原产物的质量之比为1∶1
难度: 中等查看答案及解析
-
某苯的同系物分子式为C8H10,其一氯代物中只有一个甲基的有( )
A. 3种 B. 4种 C. 7种 D. 8种
难度: 简单查看答案及解析
-
在指定的条件下,下列各组离子能大量共存的是( )
A. 由H2O电离出的c(H+)=10-11mol/L溶液中:Na+、HCO3-、AlO2-、SO42-
B. 强碱性溶液中:K+、Na+、ClO-、S2-
C. 1 mol·L-1 FeCl3溶液中:H+、Na+、SCN-、SO42-
D. 使甲基橙变红的溶液中:Fe2+、Na+、I-、NH4+
难度: 中等查看答案及解析
-
向四支试管中分别加入少量不同的无色溶液进行如下操作;结论正确的是( )
操作
现象
结论
A
滴加盐酸酸化的BaCl2溶液
生成白色沉淀
原溶液中有SO42-
B
滴加稀NaOH溶液;将湿润红色石蕊试纸置于试管
试纸不变蓝
原溶液中无NH4+
C
用洁净铂丝蘸取某溶液进行焰色反应
火焰呈黄色
原溶液中一定有Na+
D
滴加氯水和CCl4;振荡、静置
下层溶液显棕红色
原溶液中有I-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
溶液中含有较高浓度的NH4+、Cl-、HSO3-、K+等离子。向其中加入少量NaClO后,溶液中离子数目一定增多的是( )
A. NH4+、Cl-、K+ B. NH4+、Cl- C. Cl-、K+ D. ClO-
难度: 中等查看答案及解析
-
萜类化合物a、b、c广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )
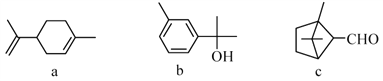
A. b和c互为同分异构体
B. a、b、c分子中所有碳原子不可能处于同一平面上
C. a、b和c均能使溴的四氯化碳溶液褪色
D. b和c均能与新制的Cu(OH)2反应生成红色沉淀
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,其中只有Y、Z处于同一周期且相邻,Z是地壳中含量最多的元素,W是短周期中金属性最强元素。下列说法不正确的是( )
A. 原子半径: r(X) <r(Y) <r(Z) <r(W)
B. W的最高价氧化物的水化物是一种强碱
C. Y的简单氢化物比Z的简单氢化物沸点低
D. X、Y、Z 三种元素可以组成共价化合物和离子化合物
难度: 中等查看答案及解析
-
常温下,Ka (HCOOH)=1.77×10-4,Ka (CH3COOH)=1.75×10-5,Kb (NH3·H2O) =1.76×10-5,下列说法正确的是( )
A. 浓度均为0.1 mol·L-1的HCOONa和NH4Cl 溶液中阳离子的物质的量浓度之和:前者小于后者
B. 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,前者消耗NaOH溶液的体积更多
C. 0.2 mol·L-1 HCOOH 与 0.1 mol·L-1 NaOH 等体积混合后的溶液中: c(HCOO-) + 2c(OH-) = c(HCOOH) + 2c(H+)
D. 0.10 mol·L-1CH3COONa溶液中通入HCl至溶液呈中性:c(Na+) =c(Cl-) >c(CH3COOH)
难度: 困难查看答案及解析
-
FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO 和H2O,当NO2、N2O4、NO 的物质的量之比为1:1:2 时,实际参加反应的FeS与HNO3的物质的量之比为( )
A. 1:5 B. 1:6 C. 1:7 D. 1:8
难度: 中等查看答案及解析
-
今有一包铁粉和铜粉混合粉末,为确定其组成,现提供4mol/L的FeCl3溶液(其他用品略),某合作学习小组同学的实验结果如下(假定反应前后溶液体积不变)
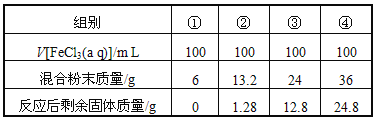
有关说法不正确的是( )
A. 第①组溶液中c(Fe3+)=2.0 mol/L
B. 第②组剩余固体只有铜
C. 第③④组反应后的滤液中c(Fe2+)=6 mol/L
D. 原混合粉末中n(Fe):n(Cu)=11:9
难度: 困难查看答案及解析
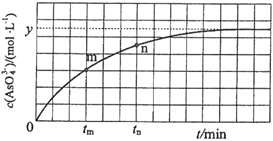


 ________________________________________________。
________________________________________________。

