-
化学的应用无处不在,下列与化学有关的叙述正确的是
A. “84消毒液”与含盐酸的洁厕灵混合使用可增强消毒效果
B. 《淮南万毕术》所述“白青得铁化为铜”涉及置换反应
C. 使用活性炭口罩可减少雾霾对人体的毒害,其原理是活性炭具有杀菌消毒作用
D. 用氢氟酸刻蚀玻璃制备工艺品,利用了氢氟酸的氧化性
难度: 中等查看答案及解析
-
下列有关有机化合物的说法正确的是
A. 苯与液溴FeBr3作催化剂的条件下发生取代反应,生成溴苯
B. 分子式为C5H10O2,且能与NaHCO3反应的有机物有3种
C. 乙醇制备乙烯和乙醇制备乙酸乙酯均为脱水的取代反应
D. 2 -甲基戊烷和4-甲基戊烷互为同分异构体
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,11g CO2含有的共用电子对数为0.5NA
B. 1mol Na分别与足量的O2反应生成Na2O或Na2O2,失去的电子数均为NA
C. 通常状况下,39 g Na2O2固体中含有的离子总数为2NA
D. 滴加到沸水中的FeCl3溶液有5.6 g Fe3+发生水解,则生成的胶粒数为0.1NA
难度: 中等查看答案及解析
-
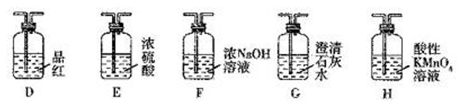
下列实验过程中的现象及结论均正确,且存在因果关系的是
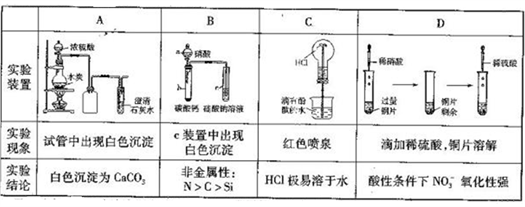
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
我国科学家发明的水溶液锂电池为电动汽车发展扫除了障碍,装置原理如下图所示,其中固体薄膜只允许Li+通过。锂离子电池的总反应为xLi +Li1-xMn2O4
LiMn2O4,下列有关说法错误的是
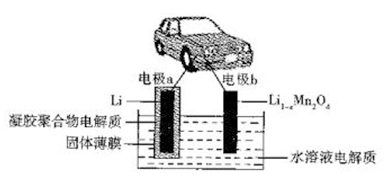
A. 放电时,Li+穿过固体薄膜进入到水溶液电解质中
B. 放电时,正极反应为Li1-xMn2O4+xLi++xe-
LiMn2O4
C. 该电池的缺点是存在副反应:2Li +2H2O
2LiOH+H2↑
D. 充电时,电极b为阳极,发生氧化反应
难度: 中等查看答案及解析
-
短周期主族元素中X、Y、Z、W的原子序数依次增大,主族元素中X的原子半径仅大于氢,Z原子的最外层电子数与最内层电子数相同,W的最低化合价的绝对值与Z的最高化合价相同。下列说法错误的是
A. 简单氢化物的沸点:X<W
B. 元素的非金属性:W<X
C. Y、Z的氧化物均含有离子键
D. Y、W形成的化合物的水溶液显碱性
难度: 中等查看答案及解析
-
已知:pOH= -lgc(OH-)。298 K时,向20.00 mL0.10mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH和pOH与加入盐酸体积关系如图所示。下列说法正确的是

A. 曲线PJN表示溶液中PH的变化
B. M点水的电离程度比Q点大
C. M、P两点的数值之和a + b = 14
D. pH与pOH交叉点J对应的V(盐酸)=20.00 mL
难度: 中等查看答案及解析



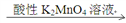
 +R3COOH;
+R3COOH;
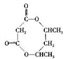 的合成路线:_________________。
的合成路线:_________________。