-
下列物质的名称、化学式、所属类别对应正确的是
A.石英 SiO2 酸 B.纯碱 Na2CO3 碱
C.绿矾 FeSO4·7H2O 盐 D.磁铁矿 Fe2O3 金属氧化物
难度: 简单查看答案及解析
-
下列说法正确的是
A.晶体硅是光导纤维的主要成分
B.碳酸钠是焙制糕点所用的发酵粉的主要成分之一
C.铝是地壳中含量最多的金属元素
D.在高炉炼铁工业中,炉渣成分为CaCO3
难度: 简单查看答案及解析
-
下列反应或现象与浓硫酸的强氧化性有关的是
A.浓硫酸可以干燥SO2、H2等气体 B.常温下浓硫酸可以使Al、Fe发生钝化
C.浓硫酸可以使蔗糖发生炭化 D.用浓硫酸和NaCl固体加热制备HCl气体
难度: 中等查看答案及解析
-
下列判断中正确的是
A.可用澄清石灰水来区分二氧化碳和二氧化硫
B.用米汤检验食用加碘盐(含KIO3)中含有碘元素
C.能使灼热的CuO由黑变红的气体一定是H2
D.可用石蕊试液来鉴别盐酸和NaOH
难度: 简单查看答案及解析
-
下列说法错误的是
A.可用“丁达尔现象”区别FeCl3溶液和Fe(OH)3胶体
B.BaCl2是一种离子晶体,其在熔融状态下可以导电
C.欲从碘水中得到碘单质,可用酒精做萃取剂
D.欲从KNO3溶液中得到KNO3晶体,可用蒸发结晶法
难度: 中等查看答案及解析
-
配制100mL0.1 mol·L-1的Na2CO3溶液,下列仪器不需要用到的是
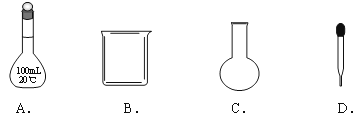
难度: 中等查看答案及解析
-
下列叙述中所描述的物质一定是金属元素的是
A.易失去电子的物质
B.原子最外电子层只有一个电子的元素
C.单质具有金属光泽的元素
D.第三周期中,原子的最外电子层只有2个电子的元素
难度: 中等查看答案及解析
-
下列说法正确的是
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能够发生
C.反应物和生成物所具有的总能量的差决定了化学反应是放热还是吸热
D.化学反应才有伴随能量变化,物理变化没有伴随能量变化
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列说法正确的是
A.5.6g铁粉与某酸反应失去的电子数一定为0.3NA
B.0.2 mol·L-1 Na2SO4溶液中所含Na+的数目为0.4NA
C.标准状况下,22.4L氢气和氮气的混合气体中含有的原子总数为2NA
D.常温常压下,等质量的O2和H2S分子个数比为1:1
难度: 困难查看答案及解析
-
已知氯化碘(ICl)的性质类似于卤素,有很强的化学活性。ICl跟Zn,H2O分别发生如下反应:2ICl+2Zn=ZnCl2+ZnI2,ICl+H2O=HCl+HIO。下列说法正确的是
A.在Zn跟ICl的反应中,ZnI2既是氧化产物又是还原产物
B.在Zn跟ICl的反应中,ZnCl2既不是氧化产物又不是还原产物
C.在H2O跟ICl的反应中,ICl 既是氧化剂又是还原剂
D.在H2O跟ICl的反应中,ICl是氧化剂
难度: 困难查看答案及解析
-
下列化学反应的离子方程式正确的是
A.在稀氨水中通入过量CO2:NH3·H2O+CO2=NH4++HCO3-
B.少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.用稀HNO3溶解FeS固体:FeS+2H+=Fe2++H2S↑
D.向NH4HCO3溶液中加入足量Ba(OH) 2溶液: 2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O
难度: 困难查看答案及解析
-
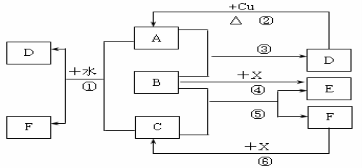
NaCl是一种化工原料,可以制备一系列物质(如下图)。下列说法正确的是

A.25 ℃,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C.电解NaCl溶液的阳极产物为H2和NaOH
D.图中所示转化反应都是氧化还原反应
难度: 中等查看答案及解析
-
下列电子式书写正确的是

难度: 中等查看答案及解析
-
实现下列变化,需克服相同类型作用力的是
A.石墨和氯化钠分别受热熔化 B.冰的融化和水的分解
C.NaCl和HCl溶于水 D.干冰和碘的升华
难度: 中等查看答案及解析
-
把下列4种X的溶液分别加入4个盛有10mL 2mol/L盐酸的烧杯中,均加水稀到50mL,此时X和盐酸和缓地进行反应。其中反应速率最大的是
A.20mL 3mol/L X 的溶液 B.20mL 2mol/L X 的溶液
C.10ml 4mol/L X 的溶液 D.10mL 2mol/L X 的溶液
难度: 中等查看答案及解析
-
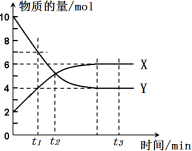
把0.6 mol X气体和0.4 mol Y气体混合于2 L容器中,发生反应:3X(g)+Y(g)
nZ(g)+2W(g),5 min末已生成0.2 mol W,若测知以Z浓度变化来表示的平均速率为0.01 mol·L-1·min-1,则n的数值为
A.1 B.2 C.3 D.4
难度: 中等查看答案及解析
-
一定条件下,将1 mol A和3 mol B充入恒容密闭容器中,发生如下反应:A(g)+3B(g)
2C(g),下列不能说明该反应已经达到平衡状态的是
A.气体的密度不再改变 B.混合气体中A的体积分数不再变化
C.混合气体的总压不再变化 D.单位时间内生成a mol A,同时生成2a mol C
难度: 中等查看答案及解析
-
下列说法或表示正确的是
A.等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨)→C(金刚石):ΔH=+119kJ/mol可知,金刚石比石墨稳定
C.在稀溶液中:H++OH-=H2O;ΔH=-57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ
D.在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l);ΔH=+285.8kJ/mol
难度: 中等查看答案及解析
-
某溶液中大量存在四种离子:NO3-、SO42-、H+、M,其物质的量之比为:n(NO3-)∶n(SO42-)∶n(H+)∶n(M)=3∶1∶3∶1,则M可能为:① Fe2+ ② Mg2+ ③ Cl- ④ Ba2+
A.①②④ B.③ C.② D.①②
难度: 中等查看答案及解析
-
在由Fe、Fe2O3组成的混合物中加入100mL2mol·L-1的盐酸,恰好使混合物完全溶解,并放出224mL气体(标准状况),此时向溶液中加入KSCN溶液无明显现象,则反应前混合物中Fe、Fe2O3的物质的量之比为
A.4:3 B.3:4 C.2:3 D.3:2
难度: 困难查看答案及解析