-
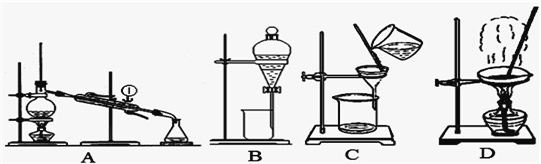
现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离这三组溶液用到的方法分别是( )
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
难度: 中等查看答案及解析
-
1mol H2O中含有的H2O分子数约为( )
A. 3.01×1023 B. 6.02×1023 C. 3 D. 1
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
A. 在标准状况下,1mol水和1molH2的体积都约是22.4L
B. 气体摩尔体积均是22.4L/mol
C. 1mol CO2气体的体积为22.4L
D. 在标准状况下,2g H2和32g O2所占的体积相等
难度: 中等查看答案及解析
-
下列溶液中的氯离子浓度最大的是 ( )
A. 1mol/L NaCl溶液 B. 2mol/L CaCl2溶液 C. 3mol/L KCl溶液 D. 1mol/L FeCl3溶液
难度: 简单查看答案及解析
-
下列关于1mol·L-1的Na2SO4溶液说法正确的是( )
A. 溶液中含有1molNa2SO4 B. 1mol Na2SO4溶于1L水中制得
C. 1L溶液中含有1 mol Na2SO4 D. Na+的浓度是1mol·L-1
难度: 简单查看答案及解析
-
在容量瓶的使用方法中,下列操作正确的是( )
A. 用容量瓶前必须对其进行干燥
B. 用浓硫酸试样配制稀硫酸时,用量筒量取试样后,直接倒入容量瓶中,缓慢加入蒸馏水到刻度线
C. 配制溶液时,把称好的固体用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2cm处
D. 定容后,盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次
难度: 简单查看答案及解析
-
相同质量的①NH3 、②O2 、③H2、④CH4气体中,标准状况下体积由大到小的顺序正确的是( )
A. ①②③④ B. ③①②④ C. ③④①② D. ②④①③
难度: 中等查看答案及解析
-
现有稀盐酸、澄清石灰水、氯化钠溶液三种无色溶液,小丽认为可选用下列四种试剂中的一种试剂进行一次性鉴别,你觉得不可行的是( )
A. 无色酚酞溶液 B. pH试纸 C. Na2CO3溶液 D. 紫色石蕊溶液
难度: 中等查看答案及解析
-
下列化学实验基本操作错误的是( )
A.
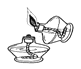 点燃酒精灯 B.
点燃酒精灯 B. 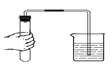 检查气密性 C.
检查气密性 C.  闻气体气味 D.
闻气体气味 D. 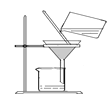 过滤粗盐水
过滤粗盐水难度: 简单查看答案及解析
-
由C16O和C18O组成的混合气体与同温、同压下空气(平均相对分子质量为29)的密度相同,则下列关系正确的是 ( )
A. 混合气体中C16O与C18O的分子数之比为14:15
B. 混合气体中C16O与C18O的物质的量之比为1:1
C. 混合气体中C16O与C18O的质量之比为15:14
D. 混合气体中C16O与C18O的密度之比为1:1
难度: 中等查看答案及解析
-
下列仪器在使用之前需要检查是否漏液的是( )
①分液漏斗 ②容量瓶 ③长颈漏斗 ④普通漏斗
A. ①② B. ①②③ C. ②③④ D. ①②③④
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述中不正确的是( )
A. 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
B. 28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
C. 常温常压下,92 g NO2和N2O4的混合气体中含有的原子总数为6NA
D. 常温常压下,22.4 L氯气与足量镁粉充分反应,生成1molMgCl2
难度: 中等查看答案及解析
-
在实验室从自来水制取蒸馏水的实验中,下列说法错误的是 ( )
A. 烧瓶中要放入碎瓷片以防止暴沸
B. 温度计的水银球位于蒸馏烧瓶的支管口处,不能插入液面
C. 冷凝水应该是下进上出,与蒸汽的流向相反
D. 开始蒸馏时,应该先加热,再通冷凝水;蒸馏完毕,应先停止通冷凝水再撤酒精灯
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数值,下列说法正确的是( )
A. 18g水所含电子数为NA B. 14 g CO和N2的混合气体所含分子数为NA
C. 16 g O2和O3的混合气体所含原子数为NA D. 58.5 g NaCl所含的离子数为NA
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A. FeCl3溶液腐蚀印刷电路铜板:Cu+Fe3+=Cu2++Fe2+
B. 醋酸溶解鸡蛋壳:2H++CaCO3=Ca2++CO2↑+H2O
C. 在NaHSO4溶液中滴入Ba(OH)2溶液至溶液呈中性:Ba2++2OH-+2H++SO
=BaSO4↓+2H2O
D. 在NaHCO3溶液中滴入少量澄清石灰水:HCO
+Ca2++OH-=CaCO3↓+H2O
难度: 中等查看答案及解析
-
某溶液中所含离子的浓度如下表,则Mn+及c值可能分别为( )
离子
NO
SO
H+
Al3+
Mn+
浓度(mol·L-1)
3
4
2
2
c
A. Ag+、1.5 B. Mg2+、1.5 C. Ba2+、1.5 D. Fe3+、0.5
难度: 中等查看答案及解析
-
下列除杂方法不正确的是
选项
物质
杂质
除杂方法
A
KNO3溶液
KOH
加入适量FeCl3溶液,过滤
B
H2
CO2
先后通过盛NaOH溶液、浓硫酸的洗气瓶
C
NaNO3
CaCO3
溶解、过滤、蒸发
D
FeSO4溶液
CuSO4
加入过量铁粉,过滤
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
在碱性溶液中,能大量共存的离子组是( )
A. K+、HCO
、Na+、SO
B. Na+、Cu2+、SO
、Cl-
C. Ba2+、NO
、Cl-、K+ D. Ca2+、K+、CO
、NO
难度: 中等查看答案及解析