-
2012年诺贝尔化学奖颁发给了生物化学领域的两位科学家:美国医学家罗伯特·J·尼科威和美国生物学家布莱恩·克比尔卡。对于两位科学家所做的研究,美国化学会主席巴萨姆·萨卡什里说:“这是向人类智慧的一次伟大致敬,它帮助我们了解在人类的身体中到底发生了什么复杂的过程。”下列选项属于2012诺贝尔化学奖获奖原因的是
A.准晶体的发现
B.G蛋白偶联受体研究
C.对有机合成中钯催化偶联反应的研究
D.发展了有机合成中的复分解法
难度: 简单查看答案及解析
-
PM 2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物。2012年2月,国务院同意发布新修订的《环境空气质量标准》增加了PM 2.5监测指标。下列情况不会增加空气中PM 2.5的是
A.露天焚烧秸秆 B.直接用煤作燃料
C.汽车排放尾气 D.利用太阳能发电
难度: 简单查看答案及解析
-
研究物质的性质的基本程序是一个系统过程,其基本程序一般分为四个过程。下列是研究物质性质的基本程序的第一步的是
A.预测物质的性质 B.观察物质的外观状态
C.进行实验和观察 D.作出相关的解释和结论
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.常温下,23 g NO2含有NA个氧原子
B.1molFe与过量的稀HNO3反应,转移2 NA个电子
C.1mol/L NaCl溶液含有NA个Na+
D.常温常压下,22.4 L的NO2和CO2混合气体含有2 NA个O原子
难度: 中等查看答案及解析
-
分类是学习和研究化学的一种的重要方法,下列分类合理的是
A.K2CO3和K2O都属于盐 B.H2SO4和HNO3都属于酸
C.KOH和Na2CO3都属于碱 D.Na2O和Na2SiO3都属于氧化物
难度: 简单查看答案及解析
-
下列实例中与胶体性质有关的是
A.铁在空气中生锈 B.用食醋除去水垢
C.用石膏使豆浆变成豆腐 D.用含Al(OH)3的药物治疗胃酸过多
难度: 简单查看答案及解析
-
已知气体的摩尔质量越小,扩散速度越快。下图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环。下列关于物质甲、乙的判断正确的是
A.甲是浓氨水,乙是浓硫酸 B.甲是浓盐酸,乙是浓氨水
C.甲是浓氨水,乙是浓盐酸 D.甲是浓硝酸,乙是浓氨水
难度: 中等查看答案及解析
-
在某溶液中仅存在NH4+、Fe3+、SO42—三种离子,已知NH4+和SO42—个数比为3︰2,则NH4+、Fe3+、SO42—三种离子的个数比为
A.6︰1︰9 B.3︰1︰2 C.1︰1︰1 D.9︰1︰6
难度: 中等查看答案及解析
-
下列反应的离子方程式不正确的是
A.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.氢氧化钠溶液与盐酸反应:OH—+H+=H2O
C.锌与硫酸铜溶液反应:Zn+Cu2+=Zn2++Cu
D.氯化钡溶液与稀硫酸反应:Ba2++SO42—=BaSO4↓
难度: 中等查看答案及解析
-
苹果汁中含有Fe2+,它是人们喜欢的一种补铁饮料,现榨的苹果汁在空气中会由淡绿色逐渐变为棕黄色。若榨汁时加入维生素C,可以防止这种现象发生。这说明维生素C有
A.还原性 B.氧化性 C.碱性 D.酸性
难度: 简单查看答案及解析
-
将Cu片放入0.1mol·L-1 FeCl3溶液中,反应进行一定时间后,取出Cu片,测得溶液中c(Fe3+)︰c(Fe2+)=2︰3,则此时溶液中Cu2+与Fe3+的物质的量之比为
A.3︰2 B.3︰5 C.3︰4 D.4︰3
难度: 中等查看答案及解析
-
在“绿色化学实验进课堂”活动中,某同学为“氯气与金属钠反应”设计了下图装置与操作以替代相关的课本实验。将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆大的金属钠(已擦净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是
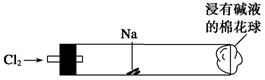
A.反应生成的大量白烟是氯化钠晶体
B.钠着火燃烧可用CO2灭火
C.玻璃管尾部浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
D.若在棉花球右侧外沿滴一滴淀粉碘化钾溶液,可据其颜色变化判断氯气是否被碱液完全吸收
难度: 中等查看答案及解析
-
下列实验能达到实验目的且符合安全要求的是
编号 实验 操作
A 钠与水反应 用镊子从煤油中取出金属钠,切下绿豆大小的钠,
小心放入装满水的烧杯中。
B 制备并检验氢气的可燃性 锌粒与稀硫酸反应产生气体,立即点燃。
C 用浓硫酸制稀硫酸 把水沿器壁倒入装有浓硫酸的烧杯中,并用玻璃
棒不断搅拌。
D 一氧化碳还原氧化铜 用石灰水检验气体产物,实验结束时先从水槽中[
取出导管,再熄灭酒精灯。
难度: 中等查看答案及解析
-
将0.15mol Fe3O4完全溶解在足量稀硫酸中,然后加入K2Cr2O7溶液250mL,恰好使溶液中Fe2+全部氧化成Fe3+,Cr2O72-全部转化成Cr3+,则K2Cr2O7溶液的物质的量浓度是
A.0.05mol/L B.0.1mol/L C.0.2mol/L D.0.3mol/L
难度: 中等查看答案及解析
-
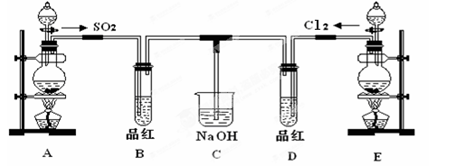
能够用于鉴别二氧化碳和二氧化硫的溶液是
A.澄清石灰水 B.品红溶液 C.酸性高锰酸钾溶液 D.BaCl2溶液
难度: 中等查看答案及解析
-
下列各组离子在溶液中能大量共存的是
A.Cu2+、Mg2+、SO42-、Cl- B.Na+、H+、Fe3+、NO3-
C.Ba2+、K+、SO42-、Cl- D.Na+、Ca2+、HCO3-、OH-
难度: 中等查看答案及解析
-
下列叙述正确的是
A.氧化还原反应中,氧化剂的氧化性强于氧化产物
B.金属阳离子被还原后,一定得到该元素的单质
C.只含有一种元素的物质不一定是纯净物
D.能与酸反应的氧化物,一定是碱性氧化物
难度: 中等查看答案及解析
-
如图所示装置,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶中,然后打开止水夹,不能出现“喷泉现象”,则物质a、b对应的选项是
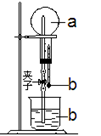
选项 a(干燥气体) b(液体)
A NO H2O
B Cl2 饱和NaCl溶液
C SO2 浓NaOH溶液
D NH3 H2O
难度: 中等查看答案及解析
-
下列物质中,分别加入少量溴水,振荡后静置,水溶液呈无色的是
A.NaOH溶液 B.NaCl溶液 C.KI溶液 D.四氯化碳
难度: 中等查看答案及解析
-
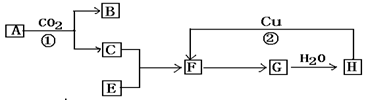
无色的混合气体甲,可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL甲气体经过如图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为
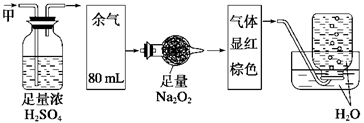
A.Na2O2在此过程中作氧化剂 B.甲气体的组成为NH3、NO、CO2
C.甲气体的组成为NH3、NO2、CO2 D.甲气体中NH3的体积分数为20%
难度: 中等查看答案及解析