-
下列关于能量变化的说法正确的是 ( )
A.“冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高
B.化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种
C.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
D.化学反应遵循质量守恒的同时,也遵循能量守恒
难度: 中等查看答案及解析
-
在以下各种情形下,下列电离方程式的书写正确的是 ( )。
A.熔融状态下的NaHSO4电离:NaHSO4===Na++H++SO42-
B.Fe(OH)3的电离:Fe(OH)3
Fe3++3OH-
C.H2CO3的电离:H2CO3
2H++CO32-
D.水溶液中的NaHSO4电离:NaHSO4===Na++HSO4-
难度: 简单查看答案及解析
-
在密闭容器中进行如下反应:X2(g)+Y2(g)
2Z(g),已知
、
、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
A. Z为0.3mol/L B.
为0.4mol/L C.
为0.2mol/L D、
为0.4mol/L
难度: 简单查看答案及解析
-
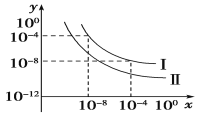
25 ℃时,0.1 mol·L-1稀醋酸加水稀释 ,如图中的纵坐标y可以是( )
A.溶液的pH B.溶液的导电能力 C.醋酸的电离平衡常数 D.醋酸的电离程度
难度: 中等查看答案及解析
-
相同体积、相同pH的某一元强酸溶液①和某一元弱酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是( )

难度: 中等查看答案及解析
-
一定温度下,向0.1 mol·L-1 CH3COOH溶液中加少量水,下列有关说法错误的是( )
A.溶液中所有离子的浓度都减小 B.CH3COOH的电离程度变大
C.水的电离程度变大 D.溶液的pH增大
难度: 简单查看答案及解析
-
25 ℃时,在1.0 L浓度均为0.01 mol·L-1的某一元酸HA与其钠盐组成的混合溶液中,测得c(Na+)>c(A-),则下列描述中不正确的是( )
A.该溶液的pH<7
B.HA的酸性很弱,A-的水解程度较大
C.c(A-)+c(HA)=0.02 mol·L-1
D.n(A-)+n(OH-)=0.01 mol+n(H+)
难度: 简单查看答案及解析
-
室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )
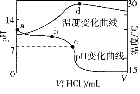
A.a点由水电离出的c(H+)=1.0×10-14mol·L-1
B.b点:c(NH)+c(NH3·H2O)=c(Cl-)
C.c点:c(Cl-)=c(NH)
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
难度: 简单查看答案及解析
-
下列叙述正确的是( )。
A.任何浓度的溶液都可以用pH来表示其酸性的强弱
B.c(H+)=1×10-7 mol·L-1的溶液一定是中性溶液
C.0.2 mol·L-1 CH3COOH溶液中的c(H+)是0.1 mol·L-1 CH3COOH溶液中的c(H+)的2倍
D.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)·c(OH-)都是定值。
难度: 中等查看答案及解析
-
下列说法错误的( )
A.0.1 mol·L-1的CH3COOH溶液中,由水电离的c(H+)为10-13mol·L-1
B.pH=2与pH=1的CH3COOH溶液中c(H+)之比为1∶10
C.等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,混合后溶液pH<7
D.1 mol甲烷分子中含有共价键的个数为4NA
难度: 中等查看答案及解析
-
如图曲线a和b是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是 ( )
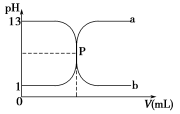
A.盐酸的物质的量浓度为1 mol·L-1 B.P点时恰好完全中和,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠溶液的滴定曲线 D.酚酞不能用作本实验的指示剂
难度: 中等查看答案及解析