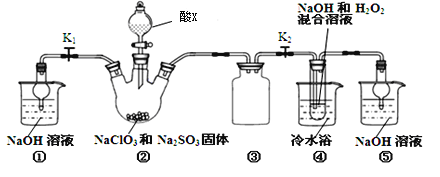
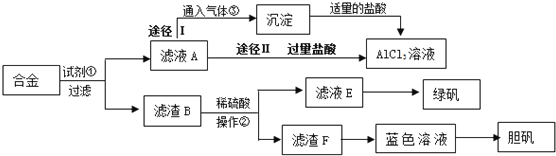
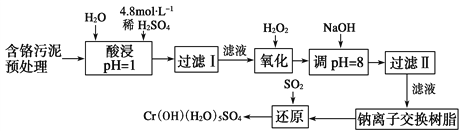
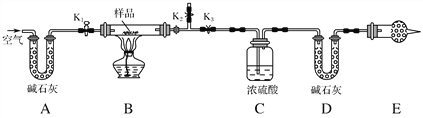
-
下列离子组能大量共存且加入相应试剂后发生反应的离子方程式正确的是( )
选项
离子组
试剂
离子方程式
A
Fe2+、NO3-、K+
稀硫酸
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
B
Fe3+、I-、ClO-
NaOH溶液
Fe3++3OH-=Fe(OH)3↓
C
Ba2+、HCO3-、Cl-
NaOH溶液
HCO3-+ OH-=CO32-+H2O
D
Ag+、NO3-、Br-
过量浓氨水
Ag++OH-=AgOH↓
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
NH3和NO2在催化剂作用下反应:8NH3+6NO2=7N2+12H2O。若还原产物比氧化产物少0.1 mol,则下列判断正确的是
A. 转移电子4.8NA个 B. 生成气体的体积42.56 L(标准状况)
C. 还原剂比氧化剂多0.2 mol D. 被还原的氮原子是ll.2 g
难度: 困难查看答案及解析
-
向含有0.2 mol FeI2溶液中加入a mol Br2。下列叙述不正确的是( )
A. a=0.1 时,发生的反应为 2I-+Br2=I2+2Br-
B. a=0.25 时,发生的反应为 4Fe2++6I-+5Br2=4Fe3++3I2+10Br-
C. 溶液中的I-一半被氧化时,c(I-)∶c(Br-)=l∶l
D. 0.2<a<0.3时(不考虑碘与水反应),溶液中各离子浓度的关系为:2c(Fe2+)+ 3c(Fe3+)+c(H+)=c(Br-)+c(OH-)
难度: 困难查看答案及解析
-
化学与生活、社会发展息息相关,下列有关说法或做法不正确的是( )
A. 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
B. 因患“禽流感”而被捕杀的家禽尸体常用生石灰处理
C. 《本草经集注》中记载了区分硝石(KNO3)和朴消(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”;这是利用了“焰色反应”
D. 煤经过气化和液化等物理变化可以转化为清洁燃料
难度: 中等查看答案及解析
-
卫生部发生公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。下列对于过氧化钙(CaO2)的叙述错误的是 ( )

A. CaO2具有氧化性,对面粉可能具有漂白作用
B. CaO2中阴阳离子的个数比为1: 1
C. CaO2和水反应时,每产生1 mol O2转移电子4 mol
D. CaO2和CO2反应的化学方程式为:2CaO2+2CO2===2CaCO3+O2
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列各项叙述中正确的有
A. pH=1的H3PO4溶液中,含有0.1NA个H+
B. 将1L 2mol/L 的FeCl3溶液加入到沸水中,加热使之完全反应,所得到的氢氧化铁胶体粒子数为2NA
C. 1L lmol.L-1 FeBr2溶液与l mol氯气反应时转移的电子数为3NA
D. 23g Na与O2充分反应生成Na2O和Na2O2的混合物,消耗O2的分子数在0.25 NA和0.5 NA之间
难度: 中等查看答案及解析
-
下列说法正确的是
A. 存在于污水中的重金属离子,常用加入明矾等电解质的方法进行处理
B. 碳酸氢钠能与碱反应,因此可用作食品的膨松剂
C. 胶片冲洗时可用硫代硫酸钠做定影液,但是不能在酸性较强的溶液中进行
D. Na2SO4 浓溶液能使蛋白质发生盐析,可用于杀菌、消毒
难度: 中等查看答案及解析
-
半导体工业中,有一句行话:“从沙滩到用户”,即SiO2制取Si。制取过程中不涉及的化学反应是
A. 2C+SiO2
Si+2CO↑
B. SiO2+2NaOH===Na2SiO3+H2O
C. Si+2Cl2
SiCl4
D. SiCl4+2H2
Si+4HCl
难度: 中等查看答案及解析
-
下列关于离子检验的说法正确的是 ( )
A. 检验溶液中是否含有Ba2+:取少量待测液,向其中加入少量稀硫酸,若有白色沉淀产生,则溶液中含有Ba2+
B. 检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可选用的试剂是酸性KMnO4溶液
C. 检验溶液中是否含有CO32-:取少量待测液,向其中加入适量稀盐酸,观察是否有大量气泡产生
D. 在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中存在SO42-或SO32-
难度: 中等查看答案及解析
-
下列除去杂质的方法不正确的是( )
A. 镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥
B. 用过量氨水除去Fe3+溶液中的少量Al3+
C. 用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
D. Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤
难度: 中等查看答案及解析
-
下列图象与对应实验操作相符合的是


A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列反应所得溶液中一定只含一种溶质的是( )
A. 向稀硝酸中加入铁粉
B. 向氯化铝溶液中加入过量的氨水
C. 向NaOH溶液中通入CO2气体
D. 向MgSO4、H2SO4的混合液中加入过量的Ba(OH)2溶液
难度: 简单查看答案及解析
-
某金属和硝酸反应,已知被还原的硝酸和参加反应的硝酸的物质的量之比为1∶6,若己知还原产物唯一,则还原产物为
A. N2 B. N2O C. NO D. NO2
难度: 困难查看答案及解析
-
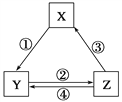
KHSO4、BaCl2、Na2CO3、FeSO4和氯水五种溶液,如图所示的相互反应,图中每条连线两端的物质可以发生化学反应.下列说法不合理的是( )
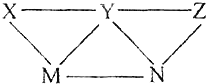
A. X一定为KHSO4 B. Y一定为Na2CO3
C. Z可能是氯水 D. M、N必定各为BaCl2、FeSO4中的一种
难度: 中等查看答案及解析
-
下列实验操作或事实与预期实验目的或所得结论对应不正确的是
选项
实验操作或事实
实验目的或结论
A
将滴有酚酞的氨水加热,红色逐渐变浅
NH3·H2O受热分解,导致溶液碱性减弱
B
在酒精灯上加热铝箔,铝箔熔化但不滴落
Al2O3的熔点高于A1
C
新收集的酸雨
白色沉淀
酸雨中一定含有SO42-
0
测同温同浓度Na2CO3和Na2SiO3水溶液的pH
确定碳和硅两元素非金属性
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是

A.在0-a范围内,只发生中和反应
B.ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
C.a=0.3
D.原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
难度: 中等查看答案及解析
-
在密闭容器中将2molNaHCO3(s)和一定量Na2O2混合,在加热条件下让其充分反应,150℃下所得气体仅含2种组分,反应后固体的物质的量(n)的取值范围是( )
A. n≥1 B. 1<n<2 C. 2≤n<4 D. n≥4
难度: 困难查看答案及解析
-
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH
、K+、Mg2+、Cu2+、Al3+、NO
、CO
、SO
,现取三份100 mL溶液进行如下实验:①第一份加足量AgNO3溶液后,有白色沉淀产生。②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,以下推测不正确的是
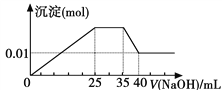
A. 原溶液一定不存在H+、Cu2+、CO
B. 不能确定原溶液是否含有K+、NO
C. 原溶液确定含Mg2+、Al3+、NH
,且n(Mg2+) ︰ n(Al3+) ︰ n(NH
)=1︰1︰2
D. 实验所加的NaOH的浓度为2 mol·L-1
难度: 困难查看答案及解析
-
关于氢氧化亚铁的制备下列说法不正确的是
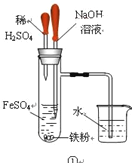

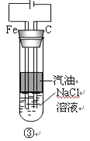

A. 装置①先加入稀硫酸,后加入氢氧化钠溶液
B. 装置②先打开止水夹a,待氢气充满试管B后再关闭止水夹
C. 装置③中的阳极反应为:2Cl--2e-=Cl2↑
D. 装置④中的苯是为了隔绝氧气
难度: 中等查看答案及解析
-
下表各组物质之间通过一步反应不可以实现如下图所示转化关系的是
选项
X
Y
Z
箭头上所标数字的反应条件
A
SiO2
Na2SiO3
H2SiO3
①与Na2CO3熔融
B
NaCl
NaHCO3
Na2CO3
②加热
C
N2
NO2
HNO3
③加热
D
C
CO
CO2
④灼热炭粉
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知酸性条件下有反应:2Cu+=Cu2++Cu。氢气还原氧化铜实验由于反应温度不同,可能产生Cu或Cu2O,两者都是红色固体。某同学对某次氢气还原氧化铜的红色固体产物做了如下实验,实验操作和实验现象列表如下:
加入
试剂
稀硫酸
浓硫酸
并加热
稀硝酸
浓硝酸
实验
现象
红色固体
不反应
无色气体
无色气体
蓝色溶液
红棕色气体
蓝色溶液
由此推出本次氢气还原氧化铜实验的产物( )
A. 是Cu B. 是Cu2O C. 一定有Cu,一定有Cu2O D. 一定有Cu2O,可能有Cu
难度: 中等查看答案及解析
-
向10.4g Fe3O4、Fe2O3、Fe的混合物中加入1 mol·L−1的硫酸溶液140mL时,固体恰好完全溶解,所得溶液中不含Fe3+,若用过量的H2在高温下还原相同质量的原混合物,固体减少的质量为( )
A.1.12g B.2.56g C.3.24g D.6.42g
难度: 中等查看答案及解析
-
常温下,在某200ml的稀硫酸和稀硝酸的混合溶液中逐量地加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(设硝酸只被还原为NO气体)。下列有关分析错误的是
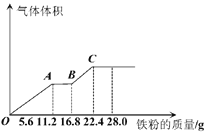
A.原混合酸中NO3-的物质的量为0.2mol
B.原混合酸中H2SO4物质的量浓度为2mol·L-1
C.OA段与BC段反应中电子转移的物质的量之比为2:1
D.取20ml原混合酸加水稀释至1L后溶液的pH=1
难度: 困难查看答案及解析
-
白磷有剧毒,白磷中毒可用硫酸铜溶液解毒,白磷与硫酸铜可以发生如下两个反应:
(1)2P+5CuSO4+8H2O=5Cu+2H3PO4+5H2SO4
(2)11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4
下列有关说法中错误的是
A. 在上述两个反应中,水既不是氧化剂也不是还原剂
B. 在上述两个反应中,氧化产物都是H3PO4
C. 在上述两个反应中,氧化剂都只有硫酸铜
D. 在反应(2)中,当有5 mol CuSO4发生反应时,共转移10 mol电子
难度: 困难查看答案及解析
-
固体粉末X中可能含有Fe、FeO、CuO、MnO2、KC1和K2CO3中的若干种。为确定该固体粉末的成分,某同学依次进行了以下实验:
①将X加入足量水中,得到不溶物Y和溶液Z
②取少量Y加入足量浓盐酸,加热,产生黄绿色气体,并有少量红色不溶物
③向Z溶液中滴加AgNO3溶液,生成白色沉淀
④用玻璃棒蘸取溶液Z于广范pH试纸上,试纸呈蓝色
分析以上实验现象,下列结论正确的是
A. X中一定不存在FeO B. 不溶物Y中一定含有Fe和CuO
C. Z溶液中一定含有KC1、K2CO3 D. Y中不一定存在MnO2
难度: 中等查看答案及解析