-
化学兴趣小组发现,往CuSO4溶液中加入一定浓度的Na2CO3溶液得到的蓝色沉淀,若加入NaOH溶液则得到浅绿色沉淀.为此,小组同学对沉淀成份作了如下探究:
I.探究蓝色沉淀的成份
[猜想]:蓝色沉淀①可能是CuCO3;②可能是Cu(OH)2;③是两者的混合物.
[设计方案]:小组同学利用下列装置通过实验测定其组成
[问题与讨论]
(1)写出②猜想的依据______.
(2)装置A中碱石灰的作用是______.
(3)检查装置气密性并装好药品后,点燃酒精灯前应进行的操作是______.
(4)若沉淀样品的质量为mg.装置C质量增加了ng,则沉淀中CuCO2的质量分数为______.
II.通过查找资料得知,该浅绿色沉淀物可能是溶解度最小的碱式硫酸铜2).请你设计一个实验,证明浊液中的浅绿色沉淀物中是否含有硫酸根离子的方法______.难度: 中等查看答案及解析
-
工业上利用硫酸渣(含Fe2-、Fe3-的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如图:
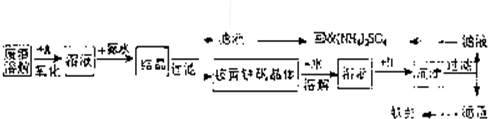
回答下列问题:
(1)在废渣溶解操作时,应选用______溶解(填编号).
A.硫酸 B.盐酸 C.氢氧化化钠 D.氨水
(2)物质A是一种氧化剂,工业上最好选用______(供选择使用的有:H2O2、空气、Cl2、MnO2等),其理由是______.
(3)根据下图有关数据,你认为工业上氧化操作时应采取的措施是______.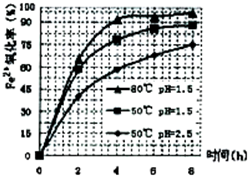
(4)往铵黄铁矾(化学式为:(NH4)2Fe6SO4)4(OH)12)溶液中加入溶液B至pH为5时产生沉淀,请写出产生沉淀的离子方程式:______.
(5)若对硫酸渣加强热也可粗制铁红,但产品纯度低而档次低,请写出硫酸渣中硫酸亚铁加强热制备铁红的化学方程式: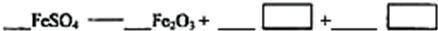
难度: 中等查看答案及解析
-
在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol•L-1和b mol•L-1,反应为:N2+3H2→2NH3,氨气的浓度随时间变化如图1所示.

(1)反应到5min时,氢气反应速率______.
(2)在10min时采取的措施是______,A的平衡常数为______,点A的平衡常数K______(填“<”、“>”或“=”)B点的平衡常数.
(3)若合成塔内生成17g氨气放出45.5kJ热量,在图2坐标上画出该合成氨反应过程中能量随时间的变化示意图.
(4)-50°C时,液氨存在如下电离:2NH3⇌NH4++NH-2,k=2×10-2,液氨的电离达到平衡时,各微粒的浓度大小关系为______,加入NH4Cl固体,K______2×10-12(填“<”、“>”或“=”)难度: 中等查看答案及解析
-
四氢呋喃是一种重要的有机化工及精细化工原料,它经下列流程合成.

回答相关的问题:
(1)写出化合物I的结构简式______;
(2)下列有关化合物II和化合物IV的叙述正确的是______;
A.化合物II能发生取代反应
B.用酸性高锰酸钾溶液能检验化合物IV中的碳碳双键
C.化合物II和化合物IV均易溶于水
D.一定条件下,化合物IV能和H2O发生加成反应
(3)化合物IV转化为化合物V的反应类型为______.
(4)已知化合物VII核磁共振氢谱有4种峰,写出由化合物VI生成化合物VII的化学反应方程式______.
(5)四氢呋喃的同分异构体有多种,写出能使新制氢氧化铜悬浊液反应的四氢呋喃的同分异构体______.
(6)四氢呋喃还可以由化合物G(C4H10O2)在少量硫酸存在下制得.写出化合物G的结构简式______.难度: 中等查看答案及解析