-
某元素R的气态氢化物的化学式为H2R,则R的最高价氧化物的水化物化学式是( )
A.H2RO3
B.HRO3
C.H3RO4
D.H2RO4难度: 中等查看答案及解析
-
下列关于燃料充分燃烧的说法,不正确的是( )
A.空气量越多越好
B.应通入适量的空气
C.固体燃料燃烧前要粉碎
D.液体燃料燃烧时可以以雾状喷出难度: 中等查看答案及解析
-
已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+和Yn-的核外电子排布相同,则下列关系式中正确的是( )
A.a=b+m+n
B.a=b-m+n
C.a=b+m-n
D.a=b-m-n难度: 中等查看答案及解析
-
能源可分为一级能源和二级能源,自然界中以现成形式提供的能源称一级能源,需依靠其他能源的能量间接制取的能源称为二级能源.据此判断,下列叙述正确的是( )
A.天然气是二级能源
B.石油是二级能源
C.电能是一级能源
D.水力是一级能源难度: 中等查看答案及解析
-
下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是( )
A.10℃20mL 3mol/L的盐酸溶液
B.20℃10mL 4mol/L的盐酸溶液
C.20℃20mL 2mol/L的盐酸溶液
D.20℃30mL 2mol/L的盐酸溶液难度: 中等查看答案及解析
-
下列过程中,共价键被破坏的是( )
A.碘升华
B.溴蒸气被木炭吸附
C.酒精溶于水
D.HCl溶于水难度: 中等查看答案及解析
-
下列说法错误的是( )
A.含有共价键的化合物一定是共价化合物
B.在共价化合物中一定含有共价键
C.含有离子键的化合物一定是离子化合物
D.双原子单质分子中的共价健一定是非极性键难度: 中等查看答案及解析
-
已知 2SO2+O2⇌2SO3为放热反应,对该反应的下列说法中正确的是( )
A.O2的能量一定高于SO2的能量
B.SO2和O2的总能量一定高于SO3的总能量
C.SO2的能量一定高于SO3的能量
D.因该反应为放热反应,故不必加热就可发生难度: 中等查看答案及解析
-
下列各离子化合物中,阳离子与阴离子的半径之比最小的是( )
A.KCl
B.NaBr
C.LiI
D.KF难度: 中等查看答案及解析
-
有A、B、C、D四种金属.将A与B用导线连接起来浸入电解质溶液中,B不易腐蚀.将A、D分别投入等浓度盐酸溶液中,D比A反应剧烈.将铜浸入B的盐溶液中,无明显变化.如果把铜浸入C的盐溶液中,有金属C析出.据此判断它们的活动性由强到弱的顺序是( )
A.D>C>A>B
B.D>A>B>C
C.D>B>A>C
D.B>A>D>C难度: 中等查看答案及解析
-
决定化学反应速率的主要因素是( )
A.参加反应的物质本身的性质
B.催化剂
C.温度、压强以及反应物的接触面
D.反应物的浓度难度: 中等查看答案及解析
-
过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是( )
A.升高温度
B.加入少量CuSO4溶液
C.加入适量的水
D.加入浓盐酸难度: 中等查看答案及解析
-
关于919F-微粒叙述正确的是( )
A.质量数为19,电子数为9
B.质子数为9,中子数为10
C.质子数为9,电子数为9
D.中子数为10,电子数为8难度: 中等查看答案及解析
-
某元素原子的原子核外有三个电子层,最外层有4个电子,该原子核内的质子数为( )
A.14
B.15
C.16
D.17难度: 中等查看答案及解析
-
下列过程中,需要增大化学反应速率的是( )
A.钢铁腐蚀
B.食物腐败
C.塑料老化
D.工业合成氨难度: 中等查看答案及解析
-
下列各组元素化合时,最易形成离子键的是( )
A.H和S
B.C和O
C.K和F
D.S和O难度: 中等查看答案及解析
-
下列反应属于吸热反应的是( )
A.锌粒与稀硫酸的反应
B.氢氧化钠与盐酸反应
C.甲烷在氧气中的燃烧反应
D.Ba(OH)2•8H2O晶体与NH4Cl晶体的反应难度: 中等查看答案及解析
-
下列分子中,含有极性共价键的是( )
A.H2O
B.Cl2
C.NaCl
D.Na2O难度: 中等查看答案及解析
-
下列各个装置中能组成原电池的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由右图表示.在下列因素中对产生H2速率没有影响的是( )
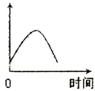
A.H+的浓度
B.镁条的表面积
C.溶液的温度
D.Cl-的浓度难度: 中等查看答案及解析
-
在2A(g)+B(g)⇌3C(g)+4D(g)中,表示该反应速率最快的是( )
A.υ(A)=0.5mol/
B.υ(B)=0.3mol/
C.υ(C)=0.8mol/
D.υ(D)=1mol/难度: 中等查看答案及解析
-
下列有关氢化物的叙述中正确的是( )
A.稳定性:H2S>HF
B.HCl的电子式为
C.一个D2O分子所含的中子数为8
D.在卤化氢中HF最稳定难度: 中等查看答案及解析
-
下列对同一周期的元素所叙递变关系错误的是( )
A.金属性逐渐减弱
B.非金属性逐渐增强
C.原子半径逐渐增大
D.最高正价数值逐渐增大难度: 中等查看答案及解析
-
铁制自来水管与下列材料作成的自来水龙头连接,自来水管锈蚀最快的是( )
A.铁水龙头
B.铜水龙头
C.塑料水龙头
D.陶瓷水龙头难度: 中等查看答案及解析