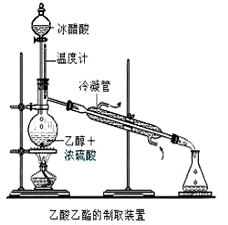
-
下列说法正确的是
A.CH4能使酸性KMnO4溶液褪色
B.金属Na能与C2H5OH中的甲基反应生成H2
C.乙酸有强烈的刺激性气味,其水溶液称为冰醋酸
D.CH3CH2CH2CH3与CH3CH(CH3)2互为同分异构体
难度: 中等查看答案及解析
-
在C(s)+CO2(g)=2CO(g)的反应中,现采取下列措施:①缩小体积,增大压强②增加碳的量③通入CO2④恒容下充入N2⑤恒压下充入N2。其中能够使反应速率增大的措施是
A. ①④ B. ②③⑤ C. ①③ D. ①②④
难度: 简单查看答案及解析
-
己知25 C、101 kPa下,下列反应C(石墨)+O2(g)=CO2(g),△H=-393.51kJ/mol;C(金刚石)+O2(g)=CO2(g),△H=-395.41kJ/mol 可以得出的结论是( )
A. 金刚石比石墨稳定 B. 1mol石墨所具有的能量比1mol金刚石低
C. 金刚石转变成石墨是物理变化 D. 石墨和金刚石都是碳的同位素
难度: 简单查看答案及解析
-
镭是元素周期表中第7周期IIA族元素,下列关于镭的性质的叙述中不正确的是( )
A. 在化合物中呈+2价 B. 单质能与水反应放出H2
C. 它的氢氧化物为强碱 D. 镭元素的金属性比钡元素的弱
难度: 简单查看答案及解析
-
下列除杂试剂的选择或除杂操作不正确的是( )
选项
括号内为杂质
除杂试剂
除杂操作
A
Fe (A1)粉
NaOH溶液.
在过量的NaOH溶液中充分反应后过滤
B
Na2O2(Na2O)固体
O2
在纯氧气中加热
C
FeCl2(FeCl3)溶液
Fe粉
加入过量Fe粉,充分反应后过滤
D
Na2CO3(NaHCO3)溶液
CO2
通入过量的CO2
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
将1.92gCu投入盛有一定量浓硝酸的试管中,当在标准状况下收集到1.12L气体时,金属铜恰好全部消耗。则反应中消耗的硝酸的物质的量为
A. 0.09mol B. 0.1.mol C. 0.11mol D. 0.12 mol
难度: 中等查看答案及解析
-
银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O、Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn+H2O=Ag+Zn(OH)2。下列说法中错误的是( )
A. 原电池放电时,负极上发生反应的物质是Zn
B. 溶液中OH-向正极移动,K+、 H+向负极移动
C. 工作时,负极区溶液pH减小,正极区pH增大
D. 负极上发生的反应是Zn+2OH--2e-=Zn(OH)2
难度: 简单查看答案及解析
-
下列反应的离子方程式,正确的是
A.Fe溶于稀盐酸:2Fe+6H+ = 2Fe3+ + 3H2↑
B.用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O
C.用FeCl3溶液腐蚀印刷电路板上铜箔:Fe3++Cu=Fe2++Cu2+
D.铝与浓氢氧化钠溶液反应:2Al+2OH-+2H2O=2AlO2-+3H2↑
难度: 中等查看答案及解析
-
下列叙述中正确的是
A. 如果存放有钠、电石等危险化学品的仓库着火,消防员不能用水灭火,应用泡沫灭火器灭火
B. 用石英制成光导纤维,由水玻璃制硅胶都是化学变化
C. 利用油脂在碱性条件下的水解,可以制得肥皂和甘油
D. 糖类、油脂、蛋白质都是高分子化合物
难度: 中等查看答案及解析
-
下列化学用语正确的是
A. 甲烷的结构式:CH4 B. 苯的分子式:C6H6
C. HClO的结构式:H-C1-O D. 氯化钠的电子式
难度: 中等查看答案及解析
-
下列说法正确的是
A. 1 mol任何气体的体积都是22.4 L
B. 1 mol H2的质量是1 g,它所占的体积是22.4 L
C. 在标准状况下,1 mol任何物质所占的体积都约是22.4 L
D. 在标准状况下,1 mol任何气体所占的体积都约是22.4 L
难度: 简单查看答案及解析
-
下列反应属于氧化还原反应的是
A.CaCO3+2HCl=CaCl2+CO2↑+H2O
B.CaO+H2O=Ca(OH)2
C.2H2O2
2H2O+O2↑
D.CaCO3
CaO+CO2↑
难度: 简单查看答案及解析
-
下列溶液中,Na+的物质的量浓度最大的是( )
A.1 mL 0.5 mol·L-1的NaNO3溶液 B.100 mL 0.01 mol·L-1的NaCl溶液
C.100 mL 0.1 mol·L-1的NaOH溶液 D.10 mL 0.1 mol·L-1的Na2SO4溶液
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的值,下列有关叙述正确的是( )
A.1 mol CH4(g)和2 mol O2(g)的能量总和小于1 mol CO2(g)和2 mol H2O(g)的能量总和
B.标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数小于2NA
C.1 mol Fe在氧气中充分燃烧失去3NA个电子
D.在标准状况下,NA个CHCl3分子所占的体积约为22.4 L
难度: 中等查看答案及解析
-
下列物质性质的递变关系正确的是
A. 酸性强弱:H3PO4 >H2SO4> HC1O4 B. 稳定性:HCl>H2S>PH3
C. 氧化性:Na+>Mg2+>Al3+ D. 碱性:NaOH>KOH>Ca(OH)2>Mg(OH)2
难度: 简单查看答案及解析
-
下列有关实验原理、仪器的使用或操作都正确的是
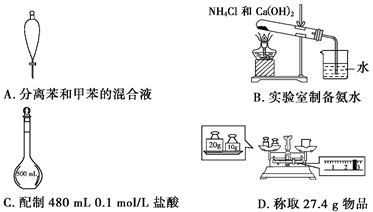
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
四种短周期元素在周期表中的位置如右图,其中只有M为金属元素。下列说法不正确的是

A. 原子半径Z<M
B. Y的最离价氧化物对应水化物的酸性比X 的弱
C. X 的最简单气态氢化物的热稳定性比Z的小
D. Z位于元索周期表中第2 周期、第ⅥA族
难度: 中等查看答案及解析
-
在一定温度下的恒容容器中.当下列物理量不再发生变化时,不能表明反应:A(s)+3B(g)
2C(g)+D(g)己达平衡状态的是( )
A. 混合气体的压强 B. 混合气体的密度
C. 3v逆(C)=2v正(B) D. 气体的平均相对分子质量
难度: 中等查看答案及解析