-
下列各组中,性质比较不正确的是( )
A.酸性:HClO4>HBrO4>HIO4
B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.稳定性:PH3>H2S>HCl
D.非金属性:F>O>S难度: 中等查看答案及解析
-
决定元素种类的是( )
A.质子数
B.中子数
C.电子数
D.最外层电子数难度: 中等查看答案及解析
-
有a、b、c、d四种金属,将a与b用导线连接起来浸入电解质溶液中,b不易腐蚀.将a、d分别投入等浓度的盐酸中,d比a反应剧烈.将Cu浸入b的盐溶液里,无明显变化.如果把Cu浸入c的盐溶液里,有c的单质析出.据此判断它们的活动性由强到弱的顺序是( )
A.d、c、a、b
B.d、a、b、c
C.d、b、a、c
D.b、a、d、c难度: 中等查看答案及解析
-
在25℃,101kPa下,1mol的白磷(化学式为P4)完全燃烧放出的热量比4mol的红磷(化学式为P)完全燃烧放出的热量多.反应方程式分别为:P4 (s)+5O2 (g)=P4O10 (s) 4P (s)+5O2 (g)=P4O10 (s)
由此判断,下列说法正确的是( )
A.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷高
B.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷低
C.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷高
D.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷低难度: 中等查看答案及解析
-
下列关于化学反应速率的说法正确的是( )
A.化学反应速率是指一定时间内任何一种反应物浓度的减少或者任何一种生成物浓度的增加
B.化学反应速率为“0.8mol/”表示的意思是:时间为1s时,某物质的浓度为0.8mol/L
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越大,反应现象越明显难度: 中等查看答案及解析
-
从化学键的角度看化学反应的实质是“旧化学键的断裂,新化学键的形成”,下列既有旧化学键的断裂,又有新化学键的形成的变化是( )
A.酒精溶解于水
B.冰融化
C.氯化钠受热熔化
D.碳酸氢铵受热产生刺激性气味气体难度: 中等查看答案及解析
-
上个世纪80年代,科学家通过研制发现了一种新分子,这种新分子具有空心的类似足球状的结构,其化学式是C60.有关C60的下列说法中正确的是( )
A.C60中可能含有离子键
B.C60中的化学键只有共价键
C.C60是一种新型的化合物
D.C60和金刚石互为同位素难度: 中等查看答案及解析
-
下列物质中,含有非极性键的离子化合物是( )
A.NaCl
B.Na2O2
C.I2
D.CH4难度: 中等查看答案及解析
-
下列说法正确的是( )
A.现在的《元素周期表》是俄国化学家门捷列夫1869年绘制的版本
B.在周期表中,把电子层数相同的元素排成一横行,称为一主族
C.元素周期表中,总共有18个纵行,18个族
D.第IA族的元素又称为碱金属元素(除了H),第VIIA族的元素又称为卤族元素难度: 中等查看答案及解析
-
如图所示装置,能够组成原电池且产生电流的是( )
A.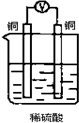
B.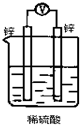
C.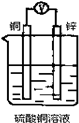
D.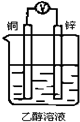
难度: 中等查看答案及解析
-
将纯锌片和纯铜片按下图所示方式插入同深度的稀硫酸中一段时间,以下叙述正确的是( )
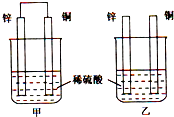
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢难度: 中等查看答案及解析
-
在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8mol•L-1和5.4mol•L-1,在一定的条件下它们反应生成NH3,10min后测得N2的浓度是0.8mol•L-1,则在这10min内NH3的平均反应速率是( )
A.0.1mol•L-1•min-1
B.0.3mol•L-1•min-1
C.0.2mol•L-1•min-1
D.0.6mol•L-1•min-1难度: 中等查看答案及解析
-
如图为短周期的一部分,推断关于Y、Z、M的说法正确的是( )
A.非金属性:Y>Z>M
B.X为稀有气体元素
C.原子半径:M>Z>Y
D.Y原子的结构示意图可表示为:难度: 中等查看答案及解析
-
哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖.现向一密闭容器中充人1molN2和3molH2,在一定条件下使该反应发生N2+3H2
2NH3,有关说法正确的是( )
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应的速率都为零难度: 中等查看答案及解析
-
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
A.CO2的电子式:
B.质量数为37的氯原子:Cl
C.NH4Cl的电子式:
D.原子核内有10个中子的氧原子:难度: 中等查看答案及解析
-
下列有关烷烃的叙述中,不正确的是( )
A.在烷烃分子中,所有的化学键都是单键
B.分子通式为CnH2n+2的烃是烷烃
C.烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去
D.所有的烷烃在光照条件下都能与氯气发生取代反应难度: 中等查看答案及解析

