-
日本福岛核电站的核原料铀—235(23592U)裂变释放出具有放射性的碘—131(13153I)和铯-137(13755Cs),下列说法正确的是
A.127I和131I互为同素异形体 B.137Cs的核电荷数为137
C.铀-235的中子数是143 D.铯与水的反应比钠和水反应缓慢
难度: 中等查看答案及解析
-
下列说法不正确的是
A.Mg的金属性比Al强
B.H+的离子半径大于Li+
C.HCl的热稳定性比HF强
D.HClO4的酸性比H3PO4强
难度: 中等查看答案及解析
-
下列分子式表示一种纯净物的是
A.C4H10 B.C C.C2H6O D.O2
难度: 中等查看答案及解析
-
不能作为判断硫、氯两种元素非金属性强弱的依据是
A.单质氧化性的强弱
B.单质沸点的高低
C.单质与氢气化合的难易
D.最高价氧化物对应的水化物酸性的强弱
难度: 中等查看答案及解析
-
下列电子式正确的是
A.
 B.
B.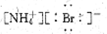
C.
 D.
D.
难度: 中等查看答案及解析
-
下列变化需克服相同类型作用力的是
A.碘和干冰的升华 B.硅和C60的熔化
C.氯化氢和氯化钠的溶解 D.溴和汞的气化
难度: 中等查看答案及解析
-
下面是一些常见分子的比例模型,其中1个分子中含有共用电子对最多的是
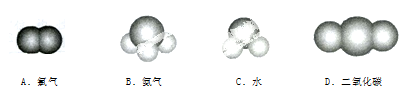
难度: 中等查看答案及解析
-
下列说法正确的是
A.原子最外层电子数为2的元素一定处于周期表的ⅡA族
B.主族元素X、Y能形成XY2型化合物,则Y与X的原子序数之差可能为2或5
C.氯化氢的沸点比氟化氢的沸点高
D.同主族元素形成的氧化物的晶体类型均相同
难度: 中等查看答案及解析
-
W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的是
A.单质的沸点:W>X
B.阴离子的还原性:W>Z
C.氧化物的水化物的酸性:Y<Z
D.X与Y不能存在于同一离子化合物中
难度: 中等查看答案及解析
-
下列顺序排列不正确的是
A.热稳定性:H2O>HF>H2S B.原子半径:Na>Mg>O
C.酸性:HClO4 >H2SO4>H3PO4 D.非金属性:F>Cl>Br
难度: 中等查看答案及解析
-
下列有关性质的比较,不能用元素周期律解释的是
A.酸性:H2SO4>H3PO4
B.非金属性:Cl>Br
C.碱性:NaOH>Mg(OH)2
D.热稳定性:Na2CO3>NaHCO3
难度: 中等查看答案及解析
-
下列说法正确的是
A.红磷转化为白磷,属于物理变化
B.石墨导电、金刚石不导电,故二者不是同素异形体
C.O2和O3分子式不同,结构相同
D.单质硫有S2、S4、S6等,它们都是硫的同素异形体
难度: 中等查看答案及解析
-
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
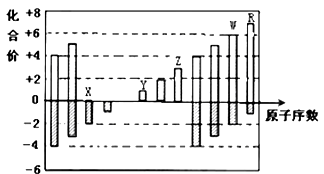
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R<W
C.WX3和水反应形成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
难度: 中等查看答案及解析
-
X、Y、Z均为短周期主族元素,其核电荷数依次增大,且它们的原子最外层电子数之比为1:4:2,下列条件中正确的是
A.X 一定是碱金属元素
B.Y 元素能形成化合物NaHYO3,且其水溶液呈碱性
C.Z 元素形成的最高价氧化物熔点较低
D.X 的单质一定能通过电解Z 的盐酸盐溶液制备
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:X>W>Z
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.元素X、Z、W的最高化合价分别与其主族序数相等
难度: 中等查看答案及解析
-
如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物。则下列说法错误的是

A.常温下,单质a呈气态 B.单质c具有强氧化性
C.稳定性:d>e D.f受热易分解为d和e
难度: 中等查看答案及解析


