-
我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应做
A.正极 B.负极 C.阴极 D.阳极
难度: 简单查看答案及解析
-
下列物质按纯净物、混合物、强电解质、弱电解质、非电解质的组合中,正确的是
纯净物
混合物
强电解质
弱电解质
非电解质
A
盐酸
水煤气
硫酸
醋酸
HD
B
冰醋酸
福尔马林
苛性钾
HI
乙醇
C
火碱
蔗糖溶液
氯化钠
氨水
三氧化硫
D
胆矾
石灰水
硫酸钡
HNO2
NH3
难度: 中等查看答案及解析
-
下列电离方程式中正确的是
A.NH3·H2O===NH+OH-
B.KClO3===K++Cl-+3O2-
C.CH3COOH===CH3COO-+H+
D.NaOH===Na++OH-
难度: 简单查看答案及解析
-
设C+CO2
2CO ΔH>0的反应速率为v1,N2 +3H2
2NH3 ΔH<0的反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
A.同时增大 B.同时减小
C.v1增大,v2减小 D.v1减小,v2增大
难度: 中等查看答案及解析
-
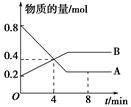
500℃,在三个相同体积的恒容密闭容器里,分别加入对应物质,甲:2 mol SO2 1 mol O2 乙:2 mol SO2 1 mol O2 1 mol N2 丙 :4 mol SO2 2 mol O2同时进行反应,开始时反应速率最大的是
A、甲 B、乙 C、丙 D、无法判断
难度: 中等查看答案及解析
-
下列关于催化剂的说法正确的是
A.使用催化剂可以增大正反应速率,减小逆反应速率
B.使用催化剂可以使化学平衡正向移动
C.使用催化剂可以降低反应的活化能
D.使用催化剂可以改变反应的平衡常数
难度: 简单查看答案及解析
-
白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体——黑磷,其转化过程中能量变化如图所示。
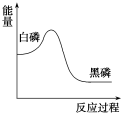
下列叙述中正确的是
A.黑磷比白磷稳定
B.黑磷与白磷互为同分异构体
C.白磷转化为黑磷是氧化还原反应
D.白磷转化为黑磷是吸热反应
难度: 中等查看答案及解析
-
可逆反应N2(g)+3H2(g)
2NH3(g)的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是
A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
难度: 中等查看答案及解析
-
某密闭容器中发生如下反应:X(g)+3Y(g)
2Z(g) ΔH<0如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。
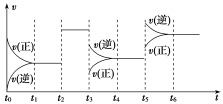
下列说法中正确的是
A.t2时加入了催化剂 B.t3时降低了温度
C.t5时增大了压强 D.t4~t5时间内转化率最低
难度: 中等查看答案及解析
-
在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质
X
Y
Z
初始浓度/mol·L-1
0.1
0.2
0
平衡浓度/mol·L-1
0.05
0.05
0.1
则25 ℃时,反应X+3Y
2Z的平衡常数为
A.500 B.600 C.1 200 D.1 600
难度: 中等查看答案及解析
-
、稀氨水中存在着下列平衡:NH3·H2O
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入适量的物质是
A、NH4Cl B、硫酸 C、NaOH固体 D、水
难度: 简单查看答案及解析
-
.在一定温度下的某容积不变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)
CO(g)+H2(g)不能确定上述可逆反应在一定条件下已达到化学平衡状态的是
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成n mol CO的同时生成n mol H2
D.1 mol H—H键断裂的同时断裂2 mol H—O键
难度: 中等查看答案及解析
-
分析下列反应在任何温度下均能自发进行的是
A.2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1
B.Ag(s)+
Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C.HgO(s)===Hg(l)+
O2(g) ΔH=+91 kJ·mol-1
D.H2O2(l)===
O2(g)+H2O(l) ΔH=-98 kJ·mol-1
难度: 中等查看答案及解析
-
下列与化学反应能量变化相关的叙述正确的是
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同
难度: 中等查看答案及解析
-
下列说法正确的是
A.氯碱工业中,烧碱在阳极区生成
B.电解熔融氯化铝冶炼金属铝
C.电镀时,用镀层金属作阳极
D.将钢闸门与外电源正极相连,可防止其腐蚀
难度: 中等查看答案及解析
-
下列金属防腐的措施中,使用外加电流的阴极保护法的是
A.水中的钢闸门连接电源的负极
B.金属护栏表面涂漆
C.汽车底盘喷涂高分子膜
D.地下钢管连接镁块
难度: 中等查看答案及解析
-
反应C (s) + H2O (g)
CO (g) + H2(g)在一可变容积的密闭容器中进行,下列条件的改变能加快其反应速率的是
A.保持体积不变,充入N2使体系压强增大
B.增加C的量
C.保持压强不变,充入N2 使容器体积变大
D.将容器的体积缩小一半
难度: 中等查看答案及解析
-
在恒容条件下,能使NO2(g)+CO(g)
CO2(g)+NO(g)正反应速率增大且活化分子的百分数也增加的措施是
A.增大NO2或CO的浓度
B.减小CO2或NO的浓度
C.通入Ne使气体的压强增大
D.升高反应的温度
难度: 中等查看答案及解析
-
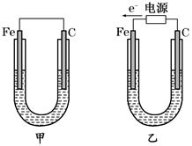
如图由锌—铜—稀H2SO4组成的原电池装置中,当导线中有0.2 mol电子通过时,理论上两极的变化是
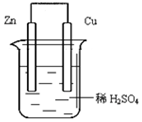
A.铜片增重6.4g B.锌片增重6.5 g
C.铜片上析出0.1 mol O2 D.锌片溶解了6.5 g
难度: 中等查看答案及解析
-
有一合金由X、Y、Z、W四种金属组成,若将合金放入盐酸中只有Z、Y能溶解;若将合金置于潮湿空气中,表面只出现Z的化合物;若将该合金做阳极,用X盐溶液作电解液,通电时四种金属都以离子形式进入溶液中,但在阴极上只析出X。这四种金属的活动性顺序是
A.Y>Z>W>X B.Z>Y>W>X
C.W>Z>Y>X D.X>Y>Z>W
难度: 中等查看答案及解析
-
对于可逆反应2AB3(g)
A2(g)+3B2(g) ΔH>0,下列图像正确的是
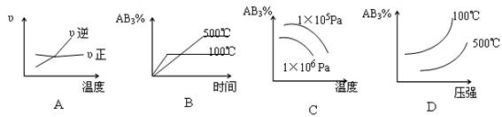
难度: 中等查看答案及解析