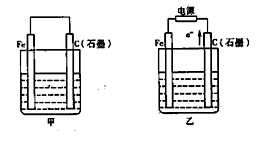
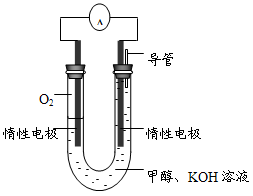
-
基态氧原子核外电子的运动状态有
A.3种 B.2种 C.8种 D.1种
难度: 简单查看答案及解析
-
下列是几种原子的基态电子排布式,电负性最大的原子是
A.1s22s22p4 B.1s22s22p63s23p3 C.1s22s22p63s23p2 D.1s22s22p63s23p64s2
难度: 简单查看答案及解析
-
下列物质是强电解质,但在该状态下不导电的是
A.铜 B.稀硫酸 C.熔融的氯化钠 D.胆矾
难度: 简单查看答案及解析
-
下列分散系中存在溶质的电离平衡的是
A 硝酸溶液 B 氢氧化钙溶液 C硫酸钡悬浊液 D 氢氧化铜悬浊液
难度: 简单查看答案及解析
-
已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨) + O2(g)=CO2(g) △H=-393.51kJ ·mol-1
C(金刚石) + O2(g)= CO2(g) △H=-395.41kJ ·mol-1
据此判断,下列说法中正确的是
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
难度: 简单查看答案及解析
-
纯锌跟稀H2SO4反应速率很小,为了加快锌的溶解和放出H2的速率,并且使产生H2的量不变,当稀H2SO4过量时,可向其中加少量
A.CuSO4溶液 B.ZnSO4 C.铜 D.镁条
难度: 简单查看答案及解析
-
下列关于电解法精炼粗铜的叙述中正确的是
A.精铜板作阴极,粗铜作阳极,CuSO4溶液作电解液
B.电解时,阴极发生氧化反应,则阴极发生的反应为:Cu2+ +2e— ==Cu
C.粗铜中所含Ni.Fe.Zn等金属杂质,电解后以单质形式沉积槽底,形成阳极泥
D.两电极质量变化值相等
难度: 简单查看答案及解析
-
下列说法正确的是:
A.有机物CH2=CH-CH3中其碳原子杂化类型有sp3 和sp2,其中有两个π键,7个σ键
B.分子CO和N2的原子总数相同,价电子总数相等,故性质相似
C.Na+的电子排布式为1s22s22p63s1
D.NO2分子的结构VSEPR模型是直线形
难度: 简单查看答案及解析
-
室温时,下列混合溶液的pH一定小于7的是
A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐酸和 pH=11的氢氧化钡溶液等体积混合
C.pH=3的醋酸和 pH=11 的氢氧化钡溶液等体积混合
D.pH=3的硫酸和 pH=11的氨水等体积混合
难度: 简单查看答案及解析
-
在25℃时将pH=11的NaOH 溶液与pH=3的CH3COOH溶掖等体积混合后,下列关系式中正确的是
A.c (Na+)==c(CH3COO-)+c(CH3COOH) B.c(H+)==c(CH3COO-)+c(OH一)
C.c (Na+) > c (CH3COO-)>c(OH-)>c(H+) D.c (CH3COO-)>c(Na+)>c(H+)>c(OH-)
难度: 简单查看答案及解析
-
已知X、Y是第三周期的非金属元素,且电负性X>Y,下列说法错误的是
A X与Y形成化合物中,X显负价,Y显正价 B第一电离能Y一定小于X
C 最高价含氧酸的酸性:X强于Y D气态氢化物的稳定性:HnY小于HmX
难度: 简单查看答案及解析
-
体积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)
2SO3(g),ΔH<0.某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
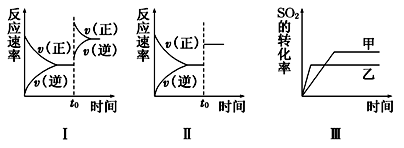
A.图Ⅰ研究的是t0时刻增大O2的浓度对反应速率的影响
B.图Ⅱ研究的是t0时刻加入催化剂后对反应速率的影响
C.图Ⅲ研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较低
难度: 简单查看答案及解析
-
如图所示装置中,a.b都是惰性电极,通电一段时间后, b极附近溶液呈红色,此时CuSO4溶液的体积为100mL,则下列说法正确的是
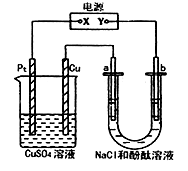
A. x是正极,y是负极,CuSO4溶液的pH 逐渐减小
B.x是正极,y是负极,CuSO4溶液的pH保持不变
C.x是负极,y是正极,CuSO4溶液的pH 逐渐减小
D.x是负极,y是正极,CuSO4溶液的pH保持不变
难度: 简单查看答案及解析
-
已知:25°C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是
A. 25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B. 25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
C.25°C时Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20mL 0.01mol/L NH4Cl溶液中的Ksp小
D. 25°C时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2
难度: 简单查看答案及解析