-
中华文化源远流长、博大精深。从化学的视角看,下列理解错误的是( )
A
B
C
D
中华
文化
“千淘万漉虽辛苦,吹尽狂沙始到金”--刘禹锡《浪涛沙》
《天工开物》锤锻篇(冶铁)记载:“谚云,‘万器以钳为祖。’非无稽之说也。”
成语“刀耕火耨(nòu)”

侯德榜
从化学
的视角
理解
诗句中的“淘、漉”相当于分离提纯操作中的“过滤”
“钳”是指作为熔铁炉、加热炉的坩埚
古人播种前先伐去树木烧掉野草,用余灰可以肥田,还可以降低土壤碱性
我国化学工业的奠基人,主要成就: 侯氏制碱法,该碱指的是纯碱
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
阿伏加德罗常数的值为NA,下列说法正确的是( )
A. 用惰性电极电解1 L 1mol/L CuSO4溶液,阴极得到的铜原子的数目一定为NA
B. 将2.3g钠投入到100ml 0.8mol/L的稀盐酸中,完全反应后可得到H2的数目为0.01NA
C. 1molCl2溶于水后溶液中Cl2、HClO、ClO-、Cl-四种粒子总数为2NA
D. 标准状况下,2molNa2O2与44.8LSO2完全反应,转移的电子数目为4NA
难度: 中等查看答案及解析
-
已知
(x)、
(y)、
(z) 的分子式均为C8H8,下列说法正确的是( )
A. x完全氢化后的产物为q,q的一氯代物有六种同分异构体
B. x、y、z中的所有原子不可能都处于同一平面上
C. 可以用y萃取溴水中的溴
D. x的同分异构体只有y和z两种
难度: 中等查看答案及解析
-
下列操作实验操作、现象、解释或结论都正确的是( )
选项
实验操作和现象
解释或结论
A
向酸性高锰酸钾溶液中加入过量FeI2固体,反应后溶液变黄
反应后溶液中存在大量Fe3+
B
将某气体通入溴水中,溶液颜色褪去
该气体可能是SO2
C
向盛有2mL0.1mo/LAgNO3溶液的试管中滴加5滴0.1mo/LNa2CO3溶液,出现白色沉淀;再往试管中滴加几滴0.1mol/LNa2S溶液,出现黑色沉淀
Ksp(Ag2CO3)>Ksp(Ag2S)
D
常温下,向pH=2的醋酸和酚酞的混合溶液中加入等体积的pH=12的NaOH溶液,充分反应后溶液变红
CHCOONa水解
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-=V3+,下列说法正确的是 ( )

A. 放电时,右槽电解液pH不变
B. 充电时,阴极电解液pH升高
C. 放电时,左槽的电极反应式:VO2++2H++e-=VO2++H2O
D. 充电时,每转移1mol电子,右槽中n(H+)的变化量为1mol
难度: 中等查看答案及解析
-
如图是部分短周期元素原子半径与原子序数的关系图,下列说法正确的是( )
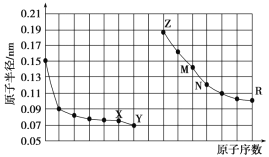
A. M、N的氧化物都能与Z、R的最高价氧化物对应水化物反应
B. Y的单质能从含R简单离子的水溶液中置换出R单质
C. X、M两种元素组成的化合物熔点很高
D. 简单离子的半径:R>M>X
难度: 中等查看答案及解析
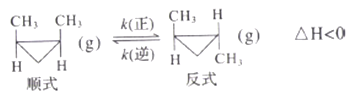
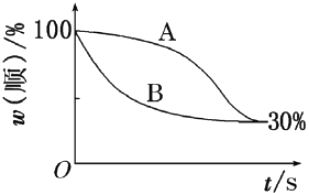

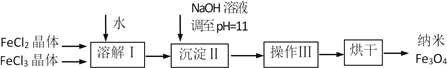
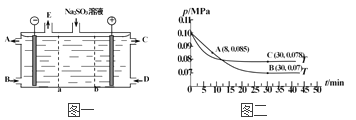

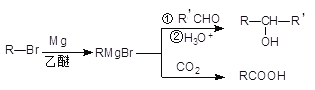

 )______________________。
)______________________。