-
实验室进行中和热测定的实验时除需要大烧杯(500 mL)、小烧杯(100 mL)外,所用的其他仪器和试剂均正确的一组是( )
A.0.50 mol·L-1盐酸,0.50 mol·L-1NaOH溶液,100 mL量筒1个
B.0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,100 mL量筒2个
C.0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,50 mL量筒1个
D.0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,50 mL量筒2个
难度: 中等查看答案及解析
-
对于化学反应中的能量变化,表述正确的是( )
A. 需要加热的化学反应都是吸热反应 B. 中和反应都是放热反应
C. 原电池是将电能转化为化学能的一种装置 D. 水力发电是将化学能转化为电能的过程
难度: 简单查看答案及解析
-
为了解决目前存在的世界性能源危机,新的替代能源主要包括( )
①核能 ②柴草 ③焦碳 ④太阳能 ⑤氢能 ⑥液化石油气 ⑦水煤气 ⑧天然气
A. ①④⑤ B. ②③⑥⑦ C. ③⑥⑦⑧ D. ①②④
难度: 简单查看答案及解析
-
下列物质的水溶液能导电,但属于非电解质的是
A. CH3COOH B. Cl2 C. (NH4)2CO3 D. SO2
难度: 简单查看答案及解析
-
下列措施或事实不能用勒夏特列原理解释的是( )
A. 新制的氯水在光照下颜色变浅 B. H2、I2、HI平衡混合气加压后颜色变深
C. 在合成氨的反应中,降温或加压有利于氨的合成 D. 红棕色NO2 加压后颜色先变深后变浅
难度: 中等查看答案及解析
-
反应①Fe(s)+CO2(g)
FeO(s)+CO(g)△H>0
反应②Fe(s)+H2O(g)
FeO(s)+H2(g)△H<0
若反应①在温度T1下进行,反应②在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)
(其他条件均相同),下面对两者反应速率大小判断正确的是( )
A. 反应①快 B. 反应②快 C. 一样大 D. 无法判断
难度: 简单查看答案及解析
-
对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s) ΔH=-444.3 kJ/mol,且熵减小,在常温常压下该反应能自发进行,对反应的方向起决定作用的是
A.焓变 B.温度 C.压强 D.熵变
难度: 简单查看答案及解析
-
下列对化学平衡移动的分析中,不正确的是( )
①已达平衡的反应C(s)+H2O(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A. ①④ B. ①②③④ C. ②③④ D. ①②③
难度: 中等查看答案及解析
-
25 ℃时,水的电离达到平衡:H2O
H++OH-;ΔH>0 ,下列叙述正确的是
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C. 向水中加入少量固体CH3COONa ,平衡逆向移动,c(H+)降低
D. 将水加热,Kw增大,pH不变
难度: 简单查看答案及解析
-
下列关于酸碱指示剂或pH试纸的说法正确的是( )
A. 将一小块pH试纸放在洁净的表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
B. 不能使无色酚酞试液变色的溶液是酸性溶液
C. 可以用紫色石蕊试液作为强酸滴定强碱的指示剂
D. 用pH试纸测定某溶液的pH=8.5,此溶液一定是某种碱的溶液
难度: 中等查看答案及解析
-
下列各表述与示意图一致的是
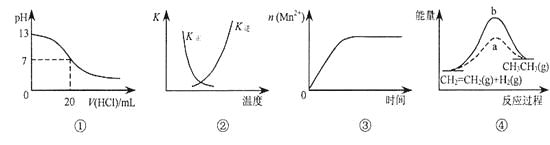
A. 图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
B. 图②中曲线表示反应2SO2(g)+ O2(g)
2SO3(g)ΔH < 0 正、逆反应的平衡常数K随温度的变化
C. 图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化
D. 图④中a、b曲线分别表示反应CH2=CH2(g)+ H2(g)→CH3CH3(g);ΔH<0使用和未使用催化剂时,反应过程中的能量变化
难度: 中等查看答案及解析
-
Bodensteins研究了下列反应:2HI(g)
H2(g)+I2(g) H=+11 kJ·mol-1。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min
0
20
40
60
80
120
x(HI)
1
0.91
0.85
0.815
0.795
0.784
x(HI)
0
0.60
0.73
0.773
0.780
0.784
由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当改变条件,再次达到平衡时,下列有关叙述不正确的是

A.若升高温度到某一温度,再次达到平衡时,相应点可能分别是A、E
B.若再次充入a mol HI,则达到平衡时,相应点的横坐标值不变,纵坐标值增大
C.若改变的条件是增大压强,再次达到平衡时,相应点与改变条件前相同
D.若改变的条件是使用催化剂,再次达到平衡时,相应点与改变条件前不同
难度: 困难查看答案及解析
-
T℃时,体积均为0.5 L的两个恒容密闭容器中发生可逆反应:2A(g)+B(g)
2C(g) △H=-Q kJ/mol(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如下表:
容器
编号
起始时各物质物质的量/mol
达平衡时体系能量的变化
A
B
C
①
2
1
0
放热 0.75 Q kJ
②
0.4
0.2
1.6
下列叙述中正确的是( )
A. 容器①、②中反应的平衡常数均为4
B. 容器②中达到平衡时放出的热量为0.05Q kJ
C. 向容器①中通入氦气,平衡时A的转化率不变
D. 其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于2/3
难度: 困难查看答案及解析
-
在密闭容器中,将一定量A、B气体混合后发生反应:xA(g)+yB(g)
zC(g)+mD(s)。平衡时得A的浓度为0.5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.3mol/L。则下列有关判断正确的是( )
A. x+y>z+m B. B的转化率一定减小 C. 平衡向正反应方向移动 D. 混合气体的密度一定减小
难度: 中等查看答案及解析
-
下列热化学方程式,正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为 CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)
2NH3(g) ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
难度: 中等查看答案及解析
-
可逆反应:3A(g)
3B(?)+C(?)△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
A. B和C可能都是固体 B. 若C为固体,则B一定是气体
C. B和C一定都是气体 D. B和C不可能都是气体
难度: 困难查看答案及解析
-
已知:HCN(aq)与NaOH(aq)反应的△H=-12.1 kJ/moL;HCl(aq)与NaOH反应的△H=-55.6 kJ/mol,则HCN在水溶液中电离的△H等于( )
A. -67.7kJ/moL B. - 43.5kJ/moL C. + 67.7kJ/moL D. + 43.5kJ/moL
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. pH=1的溶液中: Fe2+,NO3-,SO42-,Na+
B. 由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+,K+,Cl-,HCO3-
C.
=1012的溶液中:NH4+,Al3+,NO3-,Cl-
D. c(Fe2+) =0.1 mol·L-1的溶液中:K+,ClO-,SO42-,SCN-
难度: 中等查看答案及解析
-
25℃时,a mol·L-1一元酸HA与b mol·L-1NaOH等体积混合后,pH为7,则下列关系一定正确的是
A. a=b B. a>b C. c (A-)= c(Na+) D. c (A-)< c(Na+)
难度: 简单查看答案及解析