-
在环境保护、资源利用等与社会可持续发展
密切相关的领域化学发挥着积极作用。下列做法与此理念相违背的是:
A.食品中大量添加苯甲酸钠等防腐剂,可有效延长其保质期
B.“地沟油”可以制成肥皂,提高资源的利用率
C.加快开发高效洁净能源转换技术,缓解能源危机
D.“APEC蓝”是2014年新的
网络词汇,形容2014年APEC会议期间北京蓝蓝
的天空。说明京津冀实施道路限行和污染企业停工等措施,对减轻雾霾、保证空气质量是有效的
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6NA
B.6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA
C.11 g超重水(T2O)含中子数为5NA
D.常温常压下,11.2 L Cl2含氯原子数为NA
难度: 中等查看答案及解析
-
下列实验操作不正确或不能达到目的的是

难度: 中等查看答案及解析
-
下列有关说法正确的是
A.2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类相同
B.乙烷、苯、葡萄糖溶液均不能使酸性高锰酸钾溶液褪色
C.苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环己烷的密度都比水大
D.乙酸乙酯在碱性条件下的水解反应称为皂化反应
难度: 简单查看答案及解析
-
近几年科学家发明的一种新型可控电池——锂水电池,工作原理如图所示。下列有关说法不正确的是
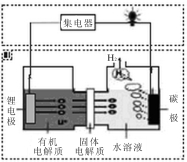
A.碳极发生的反应是:2H2O+2e-=H2↑+2OH -
B.有机电解质和水溶液不可以互换区域
C.标况下产生22.4L的氢气时,正极消耗锂的质量为14g
D.该装置不仅可提供电能,还可得到清洁的氢气
难度: 简单查看答案及解析
-
短周期元素W、X、Y、Z在元素周期表中的位置如图所示,其中W的单质是空气的主要成分,化学性质稳定,不易参加化学反应,则下列有关说法中错误的是

A.W和Y可以形成稳定的化合物,耐热性好,是新型陶瓷材料
B.Z元素的最高价氧化物水化物的酸性强于Y
C.四种元素常见的氢化物,一定是Y元素形成的氢化物最不稳定
D.向氢化物WH3与HZ反应后的集气瓶中加入足量的水,所得溶液一定呈酸性。
难度: 中等查看答案及解析
-
25 ℃时,向 10 mL 0.01 mol·L-1KOH 溶液中滴加0.01 mol·L-1苯酚溶液,混合溶液中粒子浓度关系正确的是( )
A.当pH>7 时,c(C6H5O-)>c(K+)>c(H+)>c(OH-)
B.当pH<7 时,c(K+)> c(C6H5O-)>c(H+)>c(OH-)
C.V[C6H5OH(aq)]=10 mL 时,c(K+)=c(C6H5O-)>c(OH-)=c(H+)
D.V[C6H5OH (aq)]=20 mL 时,c(C6H5O-)+c(C6H5OH)=2c(K+)
难度: 简单查看答案及解析



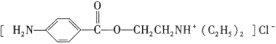 )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下: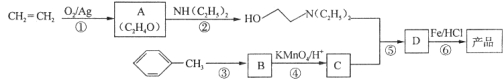
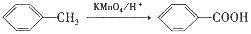
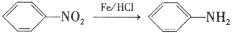
 )是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式____________________________________________________________。
)是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式____________________________________________________________。