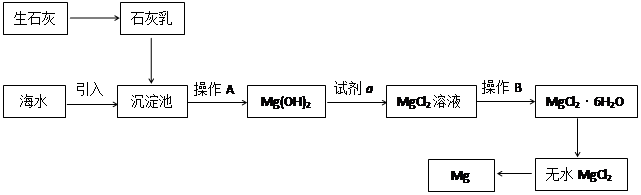
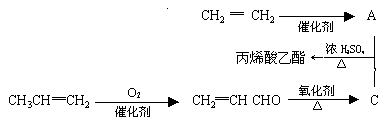
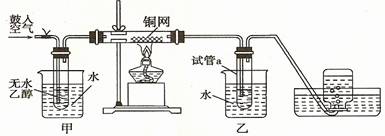
-
下列变化一定是吸热反应的是:
A.凡需加热后才能发生的反应 B.所有的分解反应
C.将化学能转变为热能的反应 D.生成物总能量大于反应物总能量的反应
难度: 简单查看答案及解析
-
下列过程所发生的化学变化属于取代反应的是:
A.苯与液溴在FeBr3催化作用下反应
B.苯与氢气在镍做催化剂的条件下反应
C.乙烯在空气中燃烧
D.乙醇在铜做催化剂的条件下生成乙醛
难度: 简单查看答案及解析
-
如图是某分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子。该分子是:
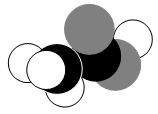
A.C2H5OH B.CH3COOH
C.CH3CHO D.C6H5OH
难度: 简单查看答案及解析
-
炒菜时,又加料酒又加醋,可使菜变得香美可口,原因是:
A.有盐类物质生成 B.有酸类物质生成
C.有油脂类物质生成 D.有酯类物质生成
难度: 简单查看答案及解析
-
分子式为C6H14的链烃中,主链有四个碳原子的同分异构体有:
A.1种 B.2种 C.3种 D.4种
难度: 简单查看答案及解析
-
乙烯能被酸性高锰酸钾溶液氧化为二氧化碳。若乙烷中混有乙烯,欲除去乙烯得到干燥纯净的乙烷,最好通过盛有下列哪组试剂的洗气瓶:
A.澄清的石灰水、浓硫酸 B.酸性高锰酸钾溶液、浓硫酸
C.溴水、浓硫酸 D.浓硫酸、酸性高锰酸钾溶液
难度: 简单查看答案及解析
-
可逆反应2SO2 + O2
2SO3达到平衡的标志是:
① 消耗2 mol SO2的同时生成2 mol SO3
② SO2、O2与SO3的物质的量之比为2∶1∶2
③ 反应混合物中,SO3的质量分数不再改变
A.① ② B.① ③ C.只有③ D.只有①
难度: 简单查看答案及解析
-
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是:
A.加热 B.不用稀硫酸,改用98%的浓硫酸
C.滴加少量CuSO4溶液 D.不用铁片,改用铁粉
难度: 简单查看答案及解析
-
已知下列元素的原子半径为:
原子
N
S
O
Si
半径/10-10m
0.75
1.02
0.74
1.17
根据以上数据,磷原子的半径可能是:
A.0.80×10-10m B.1.10×10-10m C.1.20×10-10m D.0.70×10-10m
难度: 简单查看答案及解析
-
与OH‑具有相同质子数和电子数的粒子是:
A.F‑ B.C1‑ C.NH3 D.H2O
难度: 简单查看答案及解析
-
下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是:
难度: 简单查看答案及解析
-
下列物质中中既含有共价键又含有离子键的是:
A.NaI B.CaCl2 C.NO2 D.KNO3
难度: 简单查看答案及解析
-
人造地球卫星用到的一种高能电池-银锌电池,它在放电时的电极反应为:Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-。据此判断,氧化银是:
A.负极,被氧化 B.负极,被还原
C.正极,被还原 D.正极,被氧化
难度: 简单查看答案及解析
-
下列实验操作能达到实验目的的是:
选项
实验操作
实验目的
A
滴加KMnO4(H+)溶液,充分振荡
确定苯中混有己烯
B
向水解后的蔗糖溶液中直接加入新制的Cu(OH)2并加热
确定蔗糖是否发生水解
C
加入金属钠
确定酒精中混有醋酸
D
加淀粉
确定KCl中含有KI
难度: 简单查看答案及解析
-
有一系列有机化合物,按以下顺序排列:CH2=CHCHO、CH2=CHCH=CHCHO、H(CH=CH)3CHO……。在该系列有机物中,分子中含碳元素的质量分数的最大值接近于:
A.75.0% B.85.7% C.92.3% D.95.6%
难度: 简单查看答案及解析
-
沼气的主要成分是CH4。0.5 mol CH4完全燃烧生成CO2和液态水时,放出445kJ热量。下列热化学方程式中,正确的是:
A.2CH4(g)+4O2(g)=2CO2(g)+4H2O(l) △H=+890kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=+890kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol
D.1/2 CH4(g)+ O2(g)=1/2CO2(g)+ H2O(g) △H=-890kJ/mol
难度: 简单查看答案及解析
-
氢气在氧气中燃烧时产生淡蓝色火焰。在反应过程中,破坏1 mol氢气中的化学键消耗的能量为Q1 k J,破坏1 mol O2中的化学键消耗的能量为Q2 k J,形成1 mol H2O中的化学键释放的能量为Q3 k J。下列关系式中,正确的是:
A. Q1+Q2 > Q3 B. 2Q1+Q2 > 2Q3 C. 2Q1+Q2 < 2Q3 D. 2Q1+Q2=2Q3
难度: 简单查看答案及解析
-
下列关于性质递变规律的叙述错误的是:
A.酸性H2SO4>H3PO4>HClO4 B.还原性Na>Mg>Al
C.氧化性Cl>S>P D.稳定性HCl>H2S>PH3
难度: 简单查看答案及解析
-
为了探究金属腐蚀的条件和快慢,某课外学习小组用不同的细金属丝将三根大小相同的普通铁钉分别固定在如下图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是:
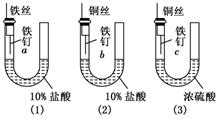
A.实验结束时,装置(1)左侧的液面一定会下降
B.实验结束时,装置(1)左侧的液面一定比装置(2)的低
C.实验结束时,铁钉b腐蚀最严重
D.实验结束时,铁钉c几乎没有被腐蚀
难度: 简单查看答案及解析
-
A、B、C三种醇分别与足量的金属钠完全反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为3∶6∶2,则A、B、C三种醇分子里羟基数之比是:
A.3∶2∶1 B.2∶6∶3
C.3∶1∶2 D.2∶1∶3
难度: 简单查看答案及解析