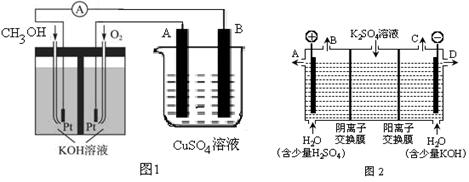
-
新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源的是
A.石油 B.太阳能 C.煤 D.天然气
难度: 简单查看答案及解析
-
下列叙述正确的是
A.通过沉淀反应,可以使溶液中某种离子的浓度变为0
B.反应NH3+H3O+NH4++H2O能自发进行,说明NH3结合H+能力比H2O强
C.若测得雨水的pH小于7,则下的是酸雨
D.先将pH试纸用蒸馏水润湿后,再测定溶液的pH
难度: 中等查看答案及解析
-
将1 mol·L-1的下列物质的水溶液,从常温加热至100 ℃,溶液的pH保持不变的是
A.氯化钠 B.氢氧化钾 C.硫酸铵 D.硫酸
难度: 中等查看答案及解析
-
用已知浓度盐酸滴定未知浓度的NaOH溶液时,下列操作使测定结果(NaOH溶液的浓度)偏高的是
A.滴定达终点时,俯视读数
B.碱液移入锥形瓶后,加入10mL蒸馏水
C.酸式滴定管用蒸馏水洗涤后,未用标准液润洗
D.滴定振荡锥形瓶过程中,有少量溶液溅出
难度: 中等查看答案及解析
-
醋酸钡晶体[(CH3COO)2Ba·H2O]是一种易溶于水的媒染剂,下列有关0.1mol·L-1醋酸钡溶液中微粒浓度的关系错误的是
A.c(Ba2+)>c(CH3COO-)>c(OH-)>c(H+) B.c(H+)+2c(Ba2+)=c(CH3COO-)+c(OH-)
C.c(H+)=c(OH-)-c(CH3COOH) D.2c(Ba2+)=c(CH3COO-)+c(CH3COOH)
难度: 困难查看答案及解析
-
关于化学平衡常数K的叙述正确的是
A.K值越大,表示化学反应速率越大
B.对任一可逆反应,温度升高,则K值增大
C.一般情况下K值越大,可逆反应进行的越彻底
D.加入催化剂或增大反应物的浓度时,K值均增大
难度: 中等查看答案及解析
-
将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如下图)。
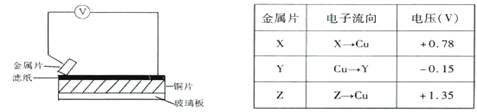
每次实验时,电压表指针的偏移方向和读数如下表。已知构成两电极的金属,活泼性相差越大,则电压越大。对X、Y、Z和铜四种金属的下列说法,不正确的是
A.Z金属可作为牺牲阳极保护法的阳极,保护Y金属
B.Y金属不能从硫酸溶液中置换出氢气
C.三种金属的活泼性顺序为:Z>X>Y
D.X和Y能构成电压最大的原电池
难度: 中等查看答案及解析
-
某同学用地下水稀释浓硫酸,将浓硫酸沿玻璃棒注入盛地下水的烧杯中时,发现烧杯中溶液变浑浊,由此推测地下水中可能含有的离子是
A.Na+ B.Ba2+ C.Mg2+ D.K+
难度: 中等查看答案及解析
-
碘与氢气一定条件下反应的热化学方程式如下
(Ⅰ) I2(g) + H2(g)
2HI(g)
H= —9.48 KJ/mol
(Ⅱ) I2(s) + H2(g)
2HI(g)
H=" 26.48" KJ/mol
下列判断正确的是
A.2 g H2(g)通入254 g I2(g) 中在该条件下反应的反应放热为9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(Ⅰ)的产物比反应(Ⅱ)的产物稳定
D.物质的量相同时,反应(Ⅰ)的反应物总能量比反应(Ⅱ)的反应物总能量高
难度: 中等查看答案及解析
-
对于可逆反应:2A(g)+B(g)
2C(g); △H <0,下列各图正确的是
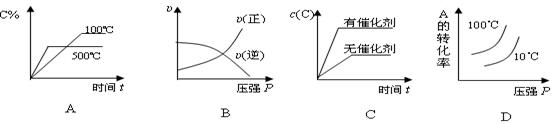
难度: 困难查看答案及解析
-
将氯化铝溶液蒸干并灼烧后得到纯净的固体A,将A在高温下熔融后用铂电极进行电解,下列有关电极产物的判断正确的是
A.阴极产物是氢气 B.阳极产物是氧气
C.阴极产物是铝和氧气 D.阳极产物只有氯气
难度: 中等查看答案及解析
-
下列说法正确的是
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.用0.2000 mol/L NaOH标准溶液滴定HCl和CH3COOH的混合溶液(混合液中两种酸的浓度均为0.1 mol/L),至中性时,溶液中的酸未被完全中和
D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,所得溶液Ag+浓度大小关系:①>④>②>③
难度: 困难查看答案及解析
-
下列装置或操作能达到实验目的的是
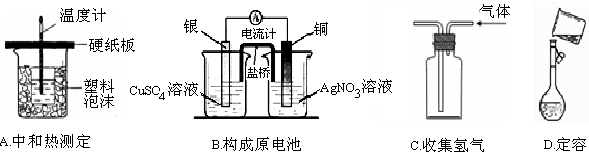
难度: 中等查看答案及解析
-
下列事实或因果关系正确的是
A.SO2的水溶液能导电说明SO2是电解质
B.HClO是弱酸,所以NaClO是弱电解质
C.某无色溶液加入NaOH溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,则该溶液含有NH4+
D.某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液一定存在大量CO32-
难度: 中等查看答案及解析
-
常温下,向pH =2的硫酸中加入等体积的下列溶液,滴入甲基橙试剂后显红色,该溶液可能是
A.pH ="12" 的Ba(OH)2 B.pH =12的氨水
C.0.01mol/L NaOH D.0.05mol/L BaCl2
难度: 中等查看答案及解析
-
常温下,下列过程能自发进行的是
A.水由高处向低处流 B.水结成冰
C.CaCO3分解为CaO和CO2 D.石墨转化为金刚石
难度: 简单查看答案及解析
-
HCN无色有杏仁气味的有毒气体,早期广泛用于船舱、仓库的烟熏灭鼠。
已知:HCN( aq)与NaOH(aq)反应的焓变ΔH=-12.1 kJ·mol-1; HCl(aq)与NaOH(aq)反应的焓变ΔH=-55.6 kJ·mol-1。则HCN在水溶液中电离的焓变ΔH等于
A.-67.7 kJ·mol-1 B.-43.5 kJ·mol-1
C.+43.5 kJ·mol-1 D.+67.7 kJ·mol-1
难度: 中等查看答案及解析
-
在H2O+CH3COO-
CH3COOH + OH—的平衡中,要使水解平衡向右移动,应采取的措施是
A.加入NaOH固体 B.加入冰醋酸 C.增大压强 D.升高温度
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.NaHS水解反应:HS-+ H2O
H3O++ S2-
B.明矾加入在水中起净化作用的原因:Al3++ 3H2O
Al(OH)3(胶体) + 3H+
C.氢氧化钡溶液与稀硫酸反应:
D.碳酸氢钠溶液中加入过量Ba(OH)2溶液:
2HCO3- + Ba2+ + 2OH- = BaCO3↓+ CO32-+ 2H2O
难度: 困难查看答案及解析
-
下列各装置中都盛有0.1 mol·L—1的NaCl溶液,放置相同时间后,锌片的腐蚀速率由快到慢的顺序是
① ② ③ ④
A.③①④② B.①②④③ C.②①④③ D.②①③④
难度: 中等查看答案及解析
-
对化学平衡移动的分析,下列说法不正确的是
①已达平衡的反应C(s)+H2O(g)
CO(g)+H2(g),当增加反应物的物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③改变外界条件使正反应速率大于逆反应速率时,化学平衡向正反应方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡不一定移动
A.①④ B.①③ C.②③ D.①②
难度: 中等查看答案及解析
-
常温下,甲溶液中水电离出的H+浓度为10-12 mol/L,乙溶液中水电离出的H+浓度为
10-2mol/L,下列说法正确的是
A.甲、乙两溶液的pH不可能相同
B.甲、乙两种溶液中加入Al粉都一定会产生H2
C.HCO3-不可能在甲、乙两溶液中大量共存
D.甲不可能是盐溶液,乙不可能是酸或碱溶液
难度: 中等查看答案及解析
-
一定条件下,可逆反应X(g)+3Y(g)
2Z(g);若X、Y、Z起始浓度分别为C1、C2、C3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol/L、0.3 mol/L、0.08 mol/L,则下列判断不合理的是
A.C1:C2=1:3 B.平衡时,Y和Z的生成速率之比为3 :2
C.反应过程中X、Y的转化率不相等 D.C1取值范围为0<C1<0.14 mol/L
难度: 中等查看答案及解析