-
关于
Lv的叙述正确的是
A. 质量数为116 B. 中子数为293 C. 电子数为293 D. 质子数为116
难度: 简单查看答案及解析
-
下列属于放热反应的是
A. 燃烧木炭取暖
B. C与CO2共热
C. 煅烧石灰石(主要成分是CaCO3)制生石灰(CaO)
D. Ba(OH)2·8H2O晶体与NH4Cl晶体反应
难度: 简单查看答案及解析
-
下列物质中,只含有非极性共价键的是
A. NH3 B. MgO C. CO2 D. Cl2
难度: 简单查看答案及解析
-
下列设备工作时,是将化学能转化为电能的是
A
B
C
D




铅蓄电池充电
锂离子电池放电
太阳能集热器
燃气灶
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
已知反应A(g)+3B(g)
2C(g),在10s内,A的浓度由4mol/L变成了2mol/L,则以A的浓度变化表示的反应速率为
A. 0.2mol/(L·s) B. 0.3 mol/(L·s) C. 0.4 mol/(L·s) D. 0.1 mol/(L·s)
难度: 简单查看答案及解析
-
下列物质不属于天然高分子化合物的是
A. 纤维素 B. 蔗糖 C. 蛋白质 D. 淀粉
难度: 简单查看答案及解析
-
根据元素周期表和元素周期律分析下面的推断,其中正确的是
A. 在金属元素和非金属元素分界线附近的元素多用于制造半导体材料
B. 氢氧化铝的碱性强于氢氧化镁的碱性
C. 磷酸的酸性强于硝酸的酸性
D. SiH4比CH4稳定
难度: 简单查看答案及解析
-
下列反应属于取代反应的是
A. 乙烯在空气中燃烧 B. 在镍做催化剂的条件下,苯与氢气反应
C. 在FeBr3催化作用下,苯与液溴反应 D. 乙醇在铜或银作催化剂条件下与氧气反应
难度: 简单查看答案及解析
-
已知
H-H
Cl-Cl
H-Cl
键能(kJ/mol)
436
243
431
对于反应H2(g)+Cl2(g)=2HCl(g)的能量变化描述正确的是
A. 436kJ/mol是指断开1 molH2中的H-H键需要放出436kJ的能量
B. 431kJ/mol是指生成2 mol HCl中的H- Cl键需要放出431kJ的能量
C. 由键能数据分析,该反应属于吸热反应
D. 2mol HCl(g)的能量比lmolH2(g)和lmolCl2(g)的总能量低
难度: 简单查看答案及解析
-
下列说法正确的是
A. 氯化镁的电子式:
B. 氯原子的原子结构示意图:

C.
Uus和
Uus互为同位素
D. 用电子式表示氯化氢的形成过程:
难度: 简单查看答案及解析
-
铜-锌原电池如图所示,电解质溶液为硫酸铜溶液,电池工作一段时间后,下列说法不正确的是
A. 锌电极上的反应为Zn-2e-=Zn2+
B. 电子从锌电极经过硫酸铜溶液流向铜电极
C. 溶液中的SO42-向锌电极移动
D. 铜电极质量增加
难度: 简单查看答案及解析
-
有机锗具有抗肿瘤活性,锗元素的部分信息如右图。则下列说法不正确的是
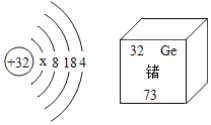
A. x=2
B. 锗元素与碳元素位于同一族,属于ⅣA族
C. 锗位于元素周期表第4周期,原子半径大于碳的原子半径
D. 距离锗原子核较远区城内运动的电子能量较低
难度: 简单查看答案及解析
-
下列说法正确的是
A. 铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,证明金属活动性:Na<Fe
B. 因为酸性H2CO3<H2SO4,所以非金属性:C<S
C. 卤素单质的颜色随核电荷数的增加而变浅
D. 因为氯的非金属性比硫强。所以还原性:Cl->S2-
难度: 中等查看答案及解析
-
氢氧燃料电池已用于航天飞机,以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应如下:2H2+4OH--4e-=4H2O,O2+2H2O+4e-=4OH-。下列叙述不正确的是
A. 氢氧燃料电池能量转化率可达100%
B. 是一种不需要将还原剂和氧化剂全部贮存在电池内的新型发电装置
C. 供电时的总反应为:2H2+O2=2H2O,产物为无污染的水,属于环境友好电池
D. 氧气在正极反生还原反应
难度: 简单查看答案及解析
-
工业上制硫酸的一步重要的反应是SO2在400-500℃下催化氧化反应: 2SO2+O2
2SO3,该反应是个正反应放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中不正确的是
A. 使用催化剂的目的是加快反应速率,提高生产效率
B. 在上述条件下,SO2不可能100%地转化为SO3
C. 增加O2的浓度,可以提高SO2的转化率
D. 当SO2和SO3的浓度相等时,反应一定达到平衡
难度: 简单查看答案及解析
-
某有机物的结构简式为CH2=CH-CH2-COOH,该有机物不可能发生的化学反应是
A. 水解 B. 酯化 C. 加成 D. 加聚
难度: 简单查看答案及解析
-
可逆反应2NO2
2NO+O2在容积固定的密闭容器中反应,达到平衡状态的标志是
A. 单位时间内生成n mol O2的同时生成2n mol NO
B. 用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
C. 混合气体的颜色不再改变的状态
D. 混合气体的总质量不再改变的状态
难度: 中等查看答案及解析
-
下列对有机物的描述不正确的是
A. 用浸泡过高锰酸钾溶液的硅土吸收水果产生的乙烯,可以达到水果保鲜的要求
B. 淀粉的特征反应是在常温下遇碘化钾溶液变蓝
C. 在加热条件下葡萄糖可与新制的氢氧化铜反应,生成砖红色沉淀
D. 硝酸可以使蛋白质变黄,称为蛋白质的颜色反应,常用来鉴别部分蛋白质
难度: 简单查看答案及解析
-
C、CO、CH4、C2H5OH是常用的燃料,他们每1mol分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为393.5kJ、283.0 kJ、890.3 kJ、1366.8 kJ。相同质量的这4种燃料,完全燃烧时放出热量最多的是:( )
A.C B. CO C. CH4 D. C2H5OH
难度: 中等查看答案及解析
-
下列关于有机物的说法中正确的是
A. 用酸性高锰酸钾溶液可以除去甲烷中的乙烯
B. 金属钠投入装有乙醇的烧杯中,可观察到钠在乙醇液面上四处游动
C. 除去乙酸乙酯中残留的乙酸。可用过量的饱和碳酸钠溶液洗涤后分液
D. 油脂、葡萄糖与水混合后静置,均不出现分层
难度: 简单查看答案及解析