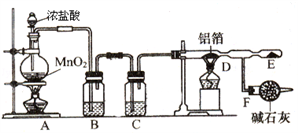
-
在一定条件下,甲苯可生成二甲苯混合物和苯。有关物质的沸点、熔点如下:
对二甲苯
邻二甲苯
间二甲苯
苯
沸点/℃
138
144
139
80
熔点/℃
13
-25
-47
6
下列说法不正确的是( )
A. 该反应属于取代反应
B. 甲苯的沸点高于144℃
C. 用蒸馏的方法可将苯从反应所得产物中首先分离出来
D. 从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来
难度: 中等查看答案及解析
-
化学与生活密切相关,下列有关说法错误的是
A. 用灼烧的方法可以区分蚕丝和人造纤维
B. 食用油反复加热会产生稠环芳香烃等有害物质
C. 加热能杀死流感病毒是因为蛋白质受热变性
D. 医用消毒酒精中乙醇的浓度为95%
难度: 简单查看答案及解析
-
下列有关说法正确的是( )
A. 维生素C具有还原性,在人体内起抗氧化作用
B. 糖类、蛋白质、油脂属于可水解的天然高分子化合物
C. 煤中含有苯和甲苯,可以先干馏在蒸馏的方法获得苯甲苯等芳香族化合物
D. 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料
难度: 中等查看答案及解析
-
下列有关表述不正确的是
A. —OH与
组成元素相同,含有的电子数也相同
B. 丙烷的分子结构模型示意图:
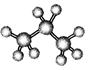
C. 次氯酸的电子式为
D. 熔化时NaHSO4的电离方程式为NaHSO4===Na++HSO
难度: 简单查看答案及解析
-
乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示。将甲醛水溶液与氨水混合蒸发可制得乌洛托品。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为

A.1:1 B.2:3 C.3:2 D.2:1
难度: 简单查看答案及解析
-
下列鉴别方法不可行的是
A. 用水鉴别乙醇、甲苯和溴苯
B. 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯
C. 用燃烧法鉴别乙醇、苯和四氯化碳
D. 用酸性高锰酸钾溶液鉴别甲苯、环己烷和环己烯
难度: 中等查看答案及解析
-
下列关于离子键、共价键的叙述中,正确的是
A. 在离子化合物里,只存在离子键,没有共价键
B. 在共价化合物分子内,一定不存在离子键
C. 只含非金属元素的化合物一定是共价化合物,
D. 由多种元素组成的多原子分子里,一定只存在极性键
难度: 中等查看答案及解析
-
假如R元素无同位素,元素R原子的质量数为A,Rm-的核外电子数为x,则W gRm-所含中子的物质的量为( )
A. (A-x+m) mol B. (A-x-m) mol
C.
(A-x+m) mol D.
(A-x-m) mol
难度: 困难查看答案及解析
-
下列大小比较正确的是
A. 酸性:HClO>H2SO4>H2CO3;非金属性Cl>S>C
B. 碱性:CsOH>KOH>Mg(OH)2>NaOH; 金属性:Cs>K>Mg>Na
C. 离子半径:Na+>Mg2+>Al3+>Cl﹣;原子半径:Na>Mg>Al>Cl
D. 稳定性:HF>H2O>NH3>CH4; 还原性:CH4>NH3>H2O>HF
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性, r溶液是一种常见的强酸,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是
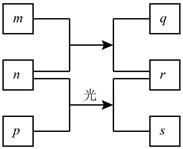
A. 原子半径的大小W<X<Y
B. 元素的非金属性Z>X>Y
C. Y的氢化物常温常压下为液态
D. X的最高价氧化物的水化物为强酸
难度: 简单查看答案及解析
-
某有机物的结构如图所示,这种有机物不可能具有的性质是

①能使酸性KMnO4溶液褪色;②可以燃烧;
③能发生水解反应;④能发生酯化反应;
⑤能发生加聚反应;⑥能跟NaOH溶液反应
A. ①④ B. 只有⑥ C. 只有③ D. ④⑥
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,22.4L苯的分子数约为NA个
B. 常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA
C. 100 mL 1 mol/L CH3COOH溶液跟足量钠反应,生成的氢气分子数为0.05 NA
D. 常温下,在1moLC5H12中含有共价键数15NA
难度: 中等查看答案及解析
-
为解决日益加剧的温室效应等问题,科学家正在研究建立如图所示的二氧化碳新循环体系:上述关系图能反映的化学观点或化学思想有
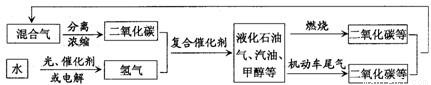
① 二氧化碳也是一种重要的资源;② 光能或电能可以转化为化学能;
③ 燃烧时化学能可以转化为热能和光能;④ 无机物和有机物可以相互转化;
⑤ 化学变化中元素种类是守恒的.
A. ①②③ B. ①④⑤ C. ①②④⑤ D. ①②③④⑤
难度: 中等查看答案及解析
-
下列装置或操作不能达到实验目的是

A. 图2中的实验现象能证明非金属性:Cl>C>Si
B. 图4可用于实验室制备并收集乙酸乙酯
C. 图3中,气体从a口进入时,可用于收集H2、CH4、NH3等气体
D. 图1中X若为CCl4,可用于吸收NH3或HCl
难度: 中等查看答案及解析
-
下列化合物的分子中,所有原子一定处于同一平面的有
A. 乙烷 B. 甲苯 C. 苯乙烯 D. 四氯乙烯
难度: 中等查看答案及解析
-
C4H8Cl2同分异构体数目为
A. 9 B. 6 C. 7 D. 8
难度: 困难查看答案及解析
-
哈伯因发明用氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖.现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生N2+3H2⇌2NH3.下列说法正确的是
A. 一定条件下达到化学平衡时,N2、H2和NH3的物质的量浓度之比为1:3:2
B. 达到化学平衡时,N2完全转化为NH3
C. 达到化学平衡时,正反应和逆反应速率相等,且都为零
D. 单位时间内消耗a mol N2同时消耗2amol NH3,说明该反应已达到平衡状态
难度: 简单查看答案及解析
-
某化学反应过程如图所示,由下图得出的判断,错误的是
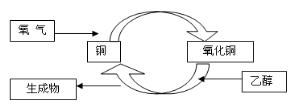
A.乙醇发生了还原反应
B.反应中有红黑颜色交替变化的现象
C.铜是此反应的催化剂
D.生成物是乙醛
难度: 中等查看答案及解析
-
在一定温度下,10mL 0.40mol/L H2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
t/min
0
2
4
6
8
10
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
下列叙述不正确的是(溶液体积变化忽略不计)
A. 0~6 min的平均反应速率:v(H2O2)≈ 3.3×10﹣2 mol/(L•min)
B. 6~10 min的平均反应速率:v(H2O2)< 3.3×10﹣2 mol/(L•min)
C. 反应到6 min时,H2O2分解了50%
D. 反应到6 min时,c(H2O2)=0.30 mol/L
难度: 简单查看答案及解析
-
PASS是新一代高效净水剂,它由X、Y、Z、W、R五种短周期元素组成,五种元素原子序数依次增大。X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,电子层数等于主族序数,W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是
A.Z与Y形成的化合物可作为耐高温材料
B.WY2能与碱反应,但不能与任何酸反应
C.原子半径按X、Y、Z、R、W的顺序依次增大
D.熔沸点:X2R>X2Y
难度: 困难查看答案及解析
-
美国科学家宣布发现了铝的“超级原子”结构﹣﹣Al13和Al14,已知这类“超级原子”最外层电子数之和为40个时处于相对稳定状态,下列说法中,正确的是
A. Al13和Al14互为同位素
B. Al14与盐酸反应的化学方程式可表示为:Al14+2HCl=Al14Cl2+H2↑
C. Al13和Al14都具有较强的还原性,容易失去电子生成阳离子
D. Al13超原子中Al原子间通过离子键结合
难度: 困难查看答案及解析
-
美国圣路易斯大学研制新型的乙醇燃料电池,用质子(H+)溶剂,在200℃左右供电.电池总反应为:C2H5OH+3O2→2CO2+3H2O,如图是该电池的示意图,下列说法正确的是

A. a极为电池的正极
B. 电池工作时电流由a极沿导线经灯泡再到b极
C. 电池正极的电极反应为:4H++O2+4e﹣═2H2O
D. 电池工作时,1mol乙醇被氧化时就有6mol电子转移
难度: 中等查看答案及解析
-
在一定温度下的恒容密闭容器中加入一定量的氨基甲酸铵(NH2COONH4),其分解反应如下:NH2COONH4(s)
2NH3(g)+CO2(g)。不能判断该分解反应已经达到化学平衡的是
A. v正(NH3)=2v逆(CO2) B. 密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变 D. 密闭容器中氨气的体积分数不变
难度: 困难查看答案及解析
-
重铬酸钾溶液中存在如下平衡:Cr2O72-(橙红色)+H2O
2H++2CrO42-(黄色),用K2Cr2O7溶液进行下列实验,结合实验下列说法不正确的是
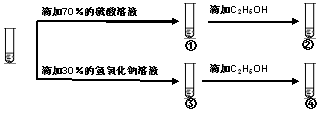
A. ①中溶液橙色加深,③中溶液变黄
B. ②中Cr2O72-被乙醇还原
C. 对比②和④可知K2Cr2O7在酸性溶液中氧化性较强
D. 若向④中加滴加70%的硫酸溶液至过量溶液变橙色
难度: 中等查看答案及解析
-
在两份相同的Ba(OH)2溶液中,分别滴加物质的量浓度相等的H2SO4溶液和NaHSO4溶液其导电能力随滴入溶液的体积变化的曲线如图所示,下列分析不正确的是:
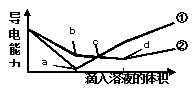
A. ①代表H2SO4溶液的变化曲线 B. b点溶液中大量存在的离子是Na+和OH-
C. c点时两溶液存在相同浓度的OH- D. a、d两点对应的溶液均显中性
难度: 困难查看答案及解析