-
下列措施不能达到节能减排目的是( )
A.利用太阳能制氢燃料
B.用家用汽车代替公交车
C.利用潮汐能发电
D.用节能灯代替白炽灯难度: 中等查看答案及解析
-
广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质.根据上述信息,下列说法不正确的是( )
A.CaO2的水解产物是Ca(OH)2和H2O2
B.PCl3的水解产物是HClO和PH3
C.NaClO的水解产物之一是HClO
D.Mg3N2的水解产物是两种碱性物质难度: 中等查看答案及解析
-
已知反应A+3B⇌2C+D在某段时间内以B的浓度变化表示的化学反应速率为1mol•L-1•min-1,则此段时间内以C的浓度变化表示的化学反应速率为( )
A.0.5mol•L-1•min-1
B.1 mol•L-1•min-1
C.0.667 mol•L-1•min-1
D.1.5 mol•L-1•min-1难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是( )
A.氯水中有平衡:Cl2+H2O⇌HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
B.对CO(g)+NO2(g)⇌CO2(g)+NO(g),平衡体系增大压强可使颜色变深
C.高压比常压条件更有利于合成氨的反应
D.SO2催化氧化成SO3的反应,往往加入过量的空气难度: 中等查看答案及解析
-
某反应过程中体系的能量变化如图所示,下列说法错误的是( )

A.反应过程可表示为A+BC(反应物)→[A…B…C](过渡态)→AB+C(产物)
B.E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能
C.正反应的热效应为△H=E1-E2,且E2>E1,所以正反应为放热反应
D.此图中逆反应的热效应△H=E1-E2,为吸热反应难度: 中等查看答案及解析
-
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的( )

A.物质的量之比为3:2
B.质量之比为3:2
C.摩尔质量之比为2:3
D.反应速率之比为2:3难度: 中等查看答案及解析
-
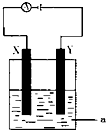
下列各个装置中铁棒被腐蚀由易到难的顺序正确的是( )

A.③①②④
B.④①③②
C.①③②④
D.②④①③难度: 中等查看答案及解析
-
在下列溶液中,各组离子一定能够大量共存的是( )
A.使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+
B.有SO42-存在的溶液中:Na+、Mg2+、Ca2+、I-
C.在pH=1的溶液中:NH4+、K+、NO3-、Cl-
D.有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br-难度: 中等查看答案及解析
-
一定温度条件下,在固定体积的密闭容器中发生反应 A(s)+2B(g)⇌C(g)+D(g),能说明该反应达到平衡状态的标志是( )
A.平衡体系的总压不变
B.平衡混合气体的平均相对分子质量不变
C.C 和D的物质的量相等
D.平衡混合气体的总物质的量不变难度: 中等查看答案及解析
-
在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液体积比是( )
A.1:9
B.1:1
C.1:2
D.1:4难度: 中等查看答案及解析
-
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
Cd+2NiOOH+2H2OCd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
A.充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的pH值不变
D.放电时电解质溶液中的OH-向正极移动难度: 中等查看答案及解析
-
将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )

A.做该实验时环境温度为22℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.00 mol/L
D.该实验表明有水生成的反应都是放热反应难度: 中等查看答案及解析
-
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )
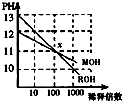
A.ROH是一种强碱
B.在x点,MOH完全电离
C.在x点,C(M+)=C(R+)
D.稀释前,c(ROH)=10c(MOH)难度: 中等查看答案及解析
-
向100mL0.2mol/L的NaOH溶液中通入标准状况下的CO2448mL,则最终溶液中微粒间关系不正确的是(假设气体完全吸收并忽略反应前后溶液体积的变化)( )
A.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
B.c(H+)+c(H2CO3)-c(CO32-)=c(OH-)
C.c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+)
D.c(HCO3-)+c(CO32-)+c(H2CO3)=0.2mol/L难度: 中等查看答案及解析
-
根据相应的图象(图象编号与选项一一对应),判断下列相关说法正确的是( )
A.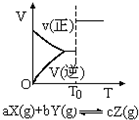
密闭容器中反应达到平衡,t时改变某一条件有如图所示,则改变的条件一定是加入催化剂
B.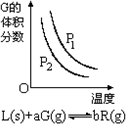
反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b
C.
物质的百分含量和温度关系如图所示,则该反应的正反应为放热反应
D.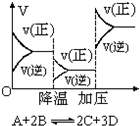
反应速率和反应条件变化如图所示,则该反应正反应为放热反应,A、B、C是气体、D为固体或液体难度: 中等查看答案及解析