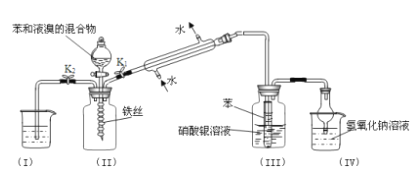
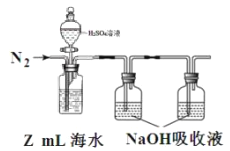
-
下列化工生产不涉及氧化还原反应的是( )
A. 工业合成氨 B. 工业冶炼钠 C. 工业制漂白粉 D. 侯氏制碱
难度: 简单查看答案及解析
-
古“丝绸之路”我国商人运出的货物有:①丝绸、②茶叶、③白糖、④瓷器、⑤纸张、⑥植物油、⑦明矾、⑧金银铜器等。下列说法正确的是
A. ④、⑦、⑧都属于盐类 B. ①、⑤ 都属于高分子化合物
C. ①、②、⑤、⑥都属于蛋白质 D. ①、②、③、④、⑤、⑥的主要成分都属于有机物
难度: 中等查看答案及解析
-
四元轴烯 t、苯乙烯 b 及立方烷 c 的分子式均为 C8H8。下列说法正确的是
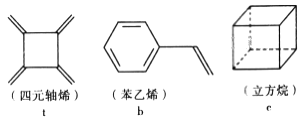
A. b 的同分异构体只有 t 和 c 两种
B. t、b、c 的二氯代物均只有三种
C. t 和b 能使酸性 KMnO4 溶液褪色而c 不能
D. t、b、c 中只有 t 的所有原子处于同一平面
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值。下列说法正确的是( )
A. 在标况下,11.2 L NO与11.2 L O2 混合后所含分子数为 0.75NA
B. 常温常压下16 g O3 所含的电子数为 8NA
C. 1 mol N2 一定条件下与足量的 H2 反应合成氨气转移的电子数为 6NA
D. 在 0.1 mol·L-1 K2CO3 溶液中,阴离子数目大于 0.1NA
难度: 中等查看答案及解析
-
化学在生活中有着广泛的应用,下列对应关系错误的是
化学性质
实际应用
A
SO2具有漂白性
SO2水溶液吸收Br2蒸气
B
ClO2具有强氧化性
自来水消毒杀菌
C
Ca(OH)2具有碱性
修复被酸雨侵蚀的土壤
D
NH3具有还原性
将烟道气中的NOx转化为N2
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列指定反应的离子方程式书写正确的是
A. 氯气通入水中:Cl2+H2O=2H++Cl-+ClO-
B. 浓氨水中通入少量二氧化硫:SO2+NH3·H2O=NH4++HSO3-
C. 铜丝插入稀硝酸中:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
D. 明矾溶液与足量Ba(OH)2溶液反应:Al3++4OH-=AlO2- +2H2O
难度: 简单查看答案及解析
-
下列有关实验的操作正确的是
实验
操作
A
检验焦炉煤气中含有甲烷
将焦炉煤气通入Cl2中,光照,观察现象
B
用粗锌(主要杂质Pb、ZnS等) 与稀硫酸制备纯净的H2
将反应产生的气体经足最KMnO4溶液洗涤,再通过碱石灰干燥
C
检验炭与热的浓硝酸产生的气体中含有CO2
将生成的气体通人澄清石灰水,观察现象
D
用MnO2、NaCl及浓硫酸加热制取少量纯净干燥的Cl2
将反应产生的气体通过浓硫酸洗涤,再通过饱和食盐水洗涤
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
由 C、H、O组成的化合物 X的球棍模型如图所示,下列说法正确的是

A. 该有机物易溶于水
B. 酸性条件下水解可生成摩尔质量相等的两种有机物
C. 与X 互为同分异构体的羧酸有3种
D. 与X 互为同分异构体的酯类有6种
难度: 简单查看答案及解析
-
微生物电解池(MEC)是一项潜在的有吸引力的绿色电解池,其制取氢气的原理如图所示:
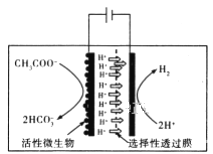
下列说法正确的是
A. MEC可在高温下工作
B. 电解池工作时,化学能转变为电能
C. 活性微生物抑制反应中电子的转移
D. 阳极的电极反应式为CH3COO-+4H2O-8e-=2HCO3-+9H+
难度: 简单查看答案及解析
-
叔丁基氯 与碱溶 液经两步反应 得到叔丁基醇,反应 (CH3)3CCl+OH-→(CH3)3COH+Cl-的能量与反应进程如图所示:
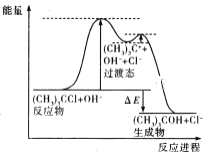
下列说法正确的是
A. 该反应为吸热反应
B. (CH3)3C+比(CH3)3 CCl 稳定
C. 第一步反应一定比第二步反应快
D. 增大碱的浓度和升高温度均可加快反应速率
难度: 中等查看答案及解析
-
某白色粉末由两种物质组成,取少量样品加入适量水中有少量气泡并有少量黄色不溶物,再向其中加入足量盐酸,固体不溶解;将上述悬浊液过滤,滤渣中加入浓硝酸并加热,固体全部溶解。则可推得该白色粉末可能为
A. Na2S2O3、NaHSO4 B. NaHCO3、KA1(SO4)2·12H2O
C. Na2SiO3、(NH4)2SO4 D. (NH4)2SO4、Ba(OH)2
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大,分别可以形成简单离子W2-、X+、Y3+、Z2-,下列判断错误的是
A. W 和 Z 在同一主族
B. Y3+、 Z2-两种离子都能促进水的电离
C. X 元素的单质能跟水剧烈反应
D. W 元素能形成两种氢化物,分子中含有类型完全相同的化学键
难度: 中等查看答案及解析
-
下列实验操作、现象及得出的结论均正确的是
选项
实验操作
现象
结论
A
向盛有品红的两支试管中分别通入SO2和Cl2
品红均褪色
两者漂白原理相同
B
向体积相同且pH均为3.3的一元酸HX 和HY 中分别加入足量锌粒
前者产生的H2比后者多
HX、HY 均是弱酸
C
在难溶盐FeS和CuS中分别加入0.3mol/L盐酸
前者溶解,后者不溶
Ksp(FeS)>Ksp(CuS)
D
向盛有相同体积、10%H2O2溶液的两支试管中分别加人足量酸性KMnO4溶液和FeCl3溶液
前者产生的气体多
KMnO4催化活性比FeCl3高
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列说法正确的是
A. 常温下同浓度的强酸、强碱等体积混合后由水电离出的 c(H+) =10-7mol·L-l
B. 常温下 pH =2 的盐酸和 pH =12 的氨水等体积混合后c(C1-)+c(H+)=c(NH4+)+c(OH-)
C. 常温下 0.1 mol/L的 Na2A 溶液的 pH=10,则该溶液中由水电离的 c(OH-)= 10-10 mol/L
D. 常温下向 10 mL0.1 mol/L的 CH3COOH 溶液中滴加相同浓度的氨水,在滴加过程中,
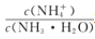 将减小
将减小难度: 困难查看答案及解析