-
下列变化需要加入氧化剂才能实现的是( )
A.Na2CO3→CO2
B.HCl→Cl2
C.H2SO4(浓)→SO2
D.CuO→Cu难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.同温同压下,相同体积的物质,其物质的量一定相等
B.任何条件下,等体积的甲烷和一氧化碳所含的分子数一定相等
C.1L一氧化碳气体一定比1L氧气的质量小
D.相同条件下的一氧化碳气体和氮气,若体积相等,则质量一定相等难度: 中等查看答案及解析
-
在某无色透明的酸性溶液中,能共存的离子组是( )
A.Na+、K+、SO42-、HCO3-
B.Cu2+、K+、SO42-、NO3-
C.Na+、K+、Cl-、NO3-
D.Fe3+、K+、SO42-、Cl-难度: 中等查看答案及解析
-
下列实验仪器不宜直接用来加热的是( )
A.试管
B.坩埚
C.蒸发皿
D.烧杯难度: 中等查看答案及解析
-
锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水.当生成1mol硝酸锌时,被还原的硝酸的物质的量为( )
A.2mol
B.1mol
C.0.5mol
D.0.25mol难度: 中等查看答案及解析
-
下列说法正确的是( )
A.电解质在熔融状态下都能导电
B.由于电流的作用,酸、碱、盐溶于水发生电离
C.存在自由移动的离子是电解质溶液导电的原因
D.某物质中仅含一种元素,该物质可能是单质也可能是化合物难度: 中等查看答案及解析
-
完全沉淀等物质的量浓度的NaCl、MgCl2、AlCl3溶液中的Cl-,消耗等物质的量浓度的AgNO3溶液的体积比为3:2:1,则上述溶液的体积比为( )
A.1:1:1
B.3:2:1
C.9:3:1
D.6:3:2难度: 中等查看答案及解析
-
下列反应中属于氧化还原反应,但水既不作氧化剂又不作还原剂的是( )
A.2H2O2H2↑+O2↑
B.Cl2+H2O=HCl+HClO
C.2F2+2H2O=4HF+O2
D.2Na+2H2O=2NaOH+H2↑难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.向氢氧化铁胶体中滴加稀硫酸,开始时产生沉淀,继续滴加时沉淀溶解
B.胶体的分散质粒子直径小于l00nm但大于1nm,能通过滤纸
C.利用丁达尔效应可以区分溶液和胶体
D.将氯化铁浓溶液和氢氧化钠浓溶液混合,能得到氢氧化铁胶体难度: 中等查看答案及解析
-
下列关于氧化还原反应的叙述正确的是( )
A.非金属单质在反应中只作氧化剂
B.某元素由化合态变成游离态,该元素一定被还原
C.HCl既有氧化性又有还原性
D.金属原子失电子越多,其还原性越强难度: 中等查看答案及解析
-
某同学在实验报告中记录下列数据,其中正确的是( )
A.用25mL量筒量取12.36mL盐酸
B.用托盘天平称量8.75g食盐
C.用广泛pH试纸测得某溶液的pH为3.5
D.用500mL的容量瓶配制450mL溶液难度: 中等查看答案及解析
-
为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序:( )
①过滤
②加过量NaOH溶液
③加适量盐酸
④加过量Na2CO3溶液
⑤加过量BaCl2溶液.
A.①④①②⑤③
B.①②⑤④①③
C.①②④⑤③
D.④②⑤难度: 中等查看答案及解析
-
已知反应:①Cl2+2KBr=2KCl+Br2,②KClO3+6HCl=3Cl2+KCl+3H2O,③2KBrO3+Cl2=Br2+2KClO3,下列说法正确的是( )
A.上述三个反应都有单质生成,所以都是置换反应
B.氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2
C.反应②中还原剂与氧化剂的物质的量之比为6:1
D.③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol难度: 中等查看答案及解析
-
下列说法正确的是( )
A.冰水为混合物
B.能在水中电离出H+的化合物叫酸
C.向稀硫酸中逐滴滴入氢氧化钡溶液,溶液的导电能力先变小后变大
D.金属氧化物均为碱性氧化物难度: 中等查看答案及解析
-
浓度为2mol/L的盐酸溶液V L,欲使其浓度变为4mol/L,下列方法可行的是( )
A.通入标况下的HCl气体44.8 L
B.将溶液加热蒸发浓缩至0.5V
C.加入10 mol/L盐酸0.6V L,再将溶液稀释至2V L
D.蒸发掉0.5 L水难度: 中等查看答案及解析
-
人体正常的血红蛋白中含有Fe2+,若误食亚硝酸盐,则使血红蛋白中Fe2+转化为Fe3+丧失其生理功能,临床证明服用维生素C可以解毒.下列叙述正确的是( )
A.中毒反应中亚硝酸盐是还原剂
B.中毒反应中Fe3+是氧化剂
C.维生素C能将亚硝酸盐氧化成硝酸盐,使其解毒
D.维生素C 能将Fe3+还原为Fe2+,使其解毒难度: 中等查看答案及解析
-
已知在酸性条件下,下列物质氧化KI时,自身发生如下变化:如果分别用等物质的量的这些物质氧化足量的KI.得到I2的量最多的是( )
A.
B.
C.
D.HNO3→NO难度: 中等查看答案及解析
-
如果 Mg2+、M、Fe3+和Cl-四种离子以物质的量之比1:3:2:2共存于同一溶液,那么M可能是( )
A.CO32-
B.NO3-
C.OH-
D.SO42-难度: 中等查看答案及解析
-
下列各组中两种溶液间的反应,能用同一离子方程式来表示的是( )
A.CH3COOH+Na2CO3;CH3COOH+NaHCO3
B.KOH+CH3COONH4;Ba(OH)2+NH4Cl
C.AgNO3+HCl;AgNO3+BaCl2
D.BaCl2和 Na2SO4;Ba(OH)2+(NH4)2SO4难度: 中等查看答案及解析
-
含某物质的溶液,其体积为V mL、密度为ρ g•mL-1,物质的量浓度为c mol•L-1,溶质的质量分数为W%,其中溶质为m g,溶质的相对分子质量为M,则下列表示正确的是( )
A.c=
B.m=
C.W%=
D.c=难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.向CaCl2溶液中通入CO2:Ca2++CO2+H2O=CaCO3↓+H+
B.石灰石与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
C.醋酸和氨水混合:CH3COOH+OH-=CH3COO-+H2O
D.向NaHSO4溶液逐滴滴加Ba(OH)2溶液至溶液的呈中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.铁与足量稀硫酸反应,产生11.2LH2,铁失去电子数目为NA
B.标准状况下,2.24L 乙醇所含的碳原子数为0.2NA
C.1molOH- 中含有的电子数为9NA
D.常温常压下,NO2和N2O4的混合物23g中含有NA个氧原子难度: 中等查看答案及解析
-
下列实验中,实验设计及所选装置合理的是( )
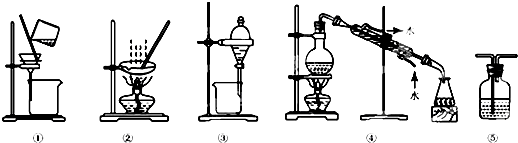
A.回收碘的四氯化碳溶液中的四氯化碳,选④
B.用酒精提取碘水中的碘,选③
C.将HCl气体从长导管通入并用水吸收,选⑤
D.粗盐提纯,选①和②难度: 中等查看答案及解析
-
在同温同压下,由CO2、H2和CO组成的混合气体的密度与氮气的密度相同.则该混合气体中CO2、H2和CO的体积比为( )
A.29:8:13
B.22:1:14
C.13:8:29
D.26:16:57难度: 中等查看答案及解析
-
已知A2On2-可与B2-反应,B2-被氧化,产物为B单质,A2On2-被还原,产物为A3+.且知100mLc(A2On2-)=0.3mol•L-1的溶液与150mLc(B2-)=0.6mol•L-1的溶液恰好完全反应,则n值为( )
A.4
B.5
C.6
D.7难度: 中等查看答案及解析