-
下列过程一定释放出能量的是
A.化合反应 B.分解反应 C.分子拆成原子 D.原子组成分子
难度: 简单查看答案及解析
-
下列物质的分类组合全部正确的是
编组
强电解质
弱电解质
非电解质
A
NaCl
HF
Cl2
B
H2SO4
BaSO4
CS2
C
NH3·H2O
HClO
Cu
D
Ba(OH)2
H2S
C2H5OH
难度: 简单查看答案及解析
-
升高温度能加快反应速率的主要原因是
A.活化分子能量明显增加 B.降低活化分子的能量
C.增加活化分子的百分数 D.降低反应所需的能量
难度: 简单查看答案及解析
-
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
A.加热 B.不用稀硫酸,改用98%的浓硫酸
C.滴加少量CuSO4溶液 D.不用铁片,改用铁粉
难度: 简单查看答案及解析
-
下列热化学方程式正确的是(注:
的绝对值均正确)
A.C2H5OH(l)+3O2(g)==2CO2(g) +3H2O(g);△H= —1367.0 kJ/mol(燃烧热)
B.NaOH(aq) + HCl(aq) == NaCl(aq) + H2O(l);△H= —57.3kJ/mol(中和热)
C.S(s) + O2(g) == SO2(g);△H= +269.8kJ/mol(反应热)
D.2NO2==O2+2NO;△H= +116.2kJ/mol(反应热)
难度: 简单查看答案及解析
-
下列说法不符合实验事实的有
A.Fe(SCN)3溶液中加入固体KSCN后颜色变深
B. 双氧水溶液中加入氯化铁溶液后没有明显现象
C.红棕色的NO2,用冰水冷却后颜色变浅
D.淀粉碘化钾溶液中加入浓硫酸,一定时间后变蓝
难度: 简单查看答案及解析
-
对可逆反应4NH3(g)+ 5O2(g)
4NO(g)+ 6H2O(g),下列叙述正确的是
A.达到化学平衡时,4υ正(O2)= 5υ逆(NO )
B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
难度: 简单查看答案及解析
-
已知:4NH3(g)+5O2(g)=4NO(g)+6H2(g);△H=-1025kJ/mol该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
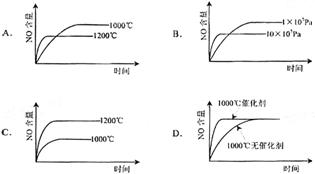
难度: 简单查看答案及解析
-
将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如上图所示(实验中始终保持 V1 + V2= 50mL)。下列叙述正确的是
A.做该实验时环境温度为22℃ B.该实验表明化学能可能转化为热能
C.NaOH溶液的浓度约为1.0mol/L D.该实验表明有水生成的反应都是放热反应
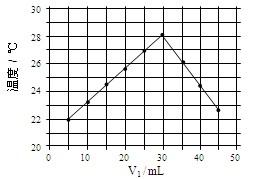
难度: 简单查看答案及解析
-
下列说法正确的是
A.热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的数据
B.升高温度或加入催化剂,可以改变化学反应的反应热
C.据能量守恒定律,反应物的总能量一定等于生成物的总能量
D.物质发生化学变化一定伴随着能量变化
难度: 简单查看答案及解析
-
对H2O的电离平衡不产生影响的粒子是:

难度: 简单查看答案及解析
-
在密闭容器中,反应N2(g)+3H2(g)
2NH3(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,改变的这一条件是
A.加入适当催化剂 B.升高温度 C.增大反应物的浓度 D.增大压强

难度: 简单查看答案及解析
-
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)
2C(气),若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法,其中正确的是
A.用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1
B.用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1
C.2 s 时物质 A的转化率为70%
D.2 s 时物质 B的浓度为 0.7 mol·L-1
难度: 简单查看答案及解析
-
氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是
A. 1mol/L氢氰酸溶液的pH约为3
B. HCN易溶于水
C. 10 mL1mol/LHCN恰好与10 mL 1mol/L NaOH溶液完全反应
D. 在相同条件下,HCN溶液的导电性比强酸溶液的弱
难度: 简单查看答案及解析
-
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质
X
Y
Z
初始浓度/mol·L-1
0.1
0.2
0
平衡浓度/mol·L-1
0.05
0.05
0.1
下列说法正确的是:
A.反应达到平衡时,X的转化率为60%
B.反应可表示为X+3Y
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
难度: 简单查看答案及解析
-
S(单斜)和S(正交)是硫的两种同素异形体。
已知:① S(单斜,s)+O2(g) === SO2(g) △H1=-297.16 kJ·mol-1
② S(正交,s)+O2(g) === SO2(g) △H2=-296.83 kJ·mol-1
③ S(单斜,s) === S(正交,s) △H3
下列说法正确的是( )
A.△H3=—0.33 kJ·mol-1
B.单斜硫转化为正交硫的反应是吸热反应
C.S(单斜,s)=== S(正交,s) △H3<0,正交硫比单斜硫稳定
D.S(单斜,s)=== S(正交,s) △H3>0,单斜硫比正交硫稳定
难度: 简单查看答案及解析