-
化学在生产和日常生活中有着重要的应用。下列叙述正确的是( )
A.白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去
B.“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料
C.SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾
D.“雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关
难度: 简单查看答案及解析
-
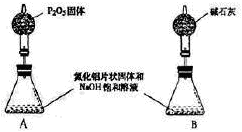
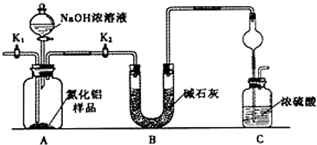
下列实验操作、现象与所得结论一致的是( )
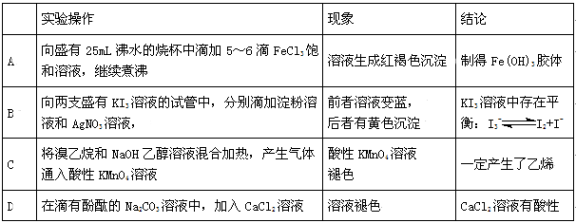
难度: 困难查看答案及解析
-
如图所示是五种短周期元素化合价与原子序数的关系,有关说法不正确的是( )

A.原子半径:R>W>Z>Y>X
B.五种原子的核外最外层电子数总和为23
C.X与Y可形成既含离子键又含共价键的化合物
D.X、Y、W可能形成水溶液呈碱性的化合物
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是()
A. 1mol铁与1molCl2充分反应,转移电子数为3NA
B.常温常压下,2gD216O中含中子数、质子数、电子数均不相等
C. 14g分子式为CnH2n的(n≥2)链烃中含有的C=C的数目一定为NA/n
D.在含A13+总数为NA的AlC13溶液中,Cl-总数为3NA
难度: 困难查看答案及解析
-
某有机物的结构简式为
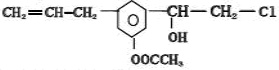 ,关于它的说法正确的是( )
,关于它的说法正确的是( )A.该物质属于芳香烃
B.该物质易溶于水
C.1mol该物质最多能与2mol NaOH反应
D.该物质能发生的反应类型有加成、水解、消去、氧化
难度: 中等查看答案及解析
-
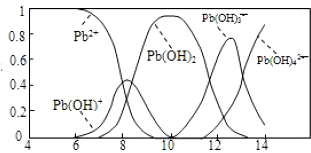
在不同温度下,水溶液中c(H+)与c(OH-)关系如图所示.下列说法不正确的是( )
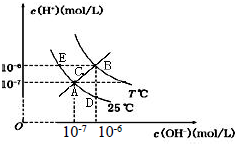
A.图中五点Kw间的关系:B>C>A=D=E
B.E 点对应的水溶液中,可能有NH 4+、Ba 2+、Cl-、I-大量同时存在
C.若0.1 mol/L 的NaHA 溶液水溶液中c(H+)与c(OH-)关系如图D 点所示,则溶液中有:c(HA-)>c(OH-)>c(A2- )>c(H2A)
D.向NaHSO4溶液中滴入Ba(OH)2溶液,当c(H+)与c(OH-)关系如图A 点所示,则溶液中反应:2H++SO4 2-+Ba2++2OH-=BaSO4↓+2H2O
难度: 困难查看答案及解析
-
已知700℃时,H2(g)+CO2(g)
H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示.其中甲经2min达平衡时,v(H2O)为0.025mol/(L•min),下列判断不正确的是( )
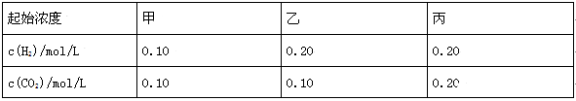
A.平衡时,乙中CO2的转化率大于50%
B.当反应平衡时,丙中c(CO2)是甲中的2倍
C.温度升至800℃,上述反应平衡常数为
,则正反应为吸热反应
D.其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/L CO2,到达平衡时c (CO)与原容器乙达平衡时c (CO)不同
难度: 困难查看答案及解析